
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Химические свойства спиртов обусловлены присутствием реакционно способной гидроксильной группы —ОН
|
|
|
|
Химические свойства спиртов обусловлены присутствием реакционно способной гидроксильной группы —ОН. Реакции с участием этой группы проходят с разрывом связей О-Н или связи С-О.
1. Кислотно-основные свойства. Спирты — вещества нейтральные, но в незначительной степени они проявляют амфотерные свойства.
При взаимодействии спиртов со щелочными металлами водород гидроксила замещается металлом с образованием алкоголятов:
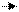 2С2Н5ОН+2Na 2C2H5ONa + Н2
2С2Н5ОН+2Na 2C2H5ONa + Н2
алкоголят (этилат натрия)
Алкоголяты легко разлагаются водой:
 С2Н5ONa+HOH C2H5OH+NaOH
С2Н5ONa+HOH C2H5OH+NaOH
так как спирты более слабые кислоты, чем вода. Кислотные свойства спиртов убывают в следующем порядке: первичные > вторичные > третичные.
Как и вода, спирты проявляют и основные свойства: они реагируют на холоду с сильными кислотами, образуя соли алкилоксония:
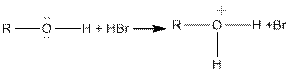
Основные свойства спиртов убывают в противоположном порядке по сравнению с кислотными.
2. Этерефикация. Cпирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих эфиров и воды:
С2H5OH+HOSO3H + H2O → C2H5OSO3H + H2O
Этилсульфат
Этилсерная кислота
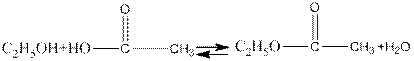
Реакция образования сложных эфиров минеральных и органических кислот обратима: на определенной стадии наступает равновесие.
Скорость образования сложных эфиров, как показал Н.А. Меншуткин, при одной и тон же кислоте для первичных спиртов примерно в два раза больше, чем для вторичных, и в 20 раз больше, чем для третичных.
3. Дегидратация. При действии на спирты водоотнимающих веществ происходит межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты (H2SO4, Н3РO4, щавелевая, бензолсульфокислота, оксиды алюминия, тория, пиросульфат калия, сульфат меди, хлорид цинка и др.).
|
|
|
При межмолекулярной дегидратации спиртов получаются простые эфиры (R—О—R или R—О—R`):
R-OH + HO-R → R-O-R + H2O
В случае внутримолекулярной дегидратации спиртов, проходящей на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды.
Эта закономерность в сочетании с правилом Марковникова дает возможность переходить от одних спиртов к другим. Например, от изобутилового спирта к третичному бутиловому спирту
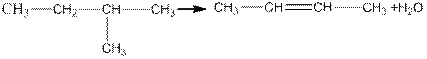
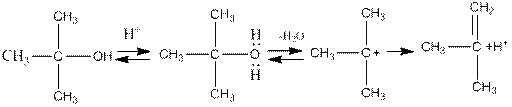
Реакции отщепления воды, как и реакции отщепления галогеноводородов, могут проходить по механизмам Е1 или Е2 в зависимости от строения спирта и условий реакции. Ниже приведена схема отщепления воды по механизму Е1 при каталитическом воздействии кислоты на третичный спирт:
4. При взаимодействии спиртов с магний галоген алкилами водород гидроксильной группы замещается на магний галоген и выделяется углеводород:
R—ОН +СН3MgI — R-ОМgI + СН4
По количеству выделившегося метана судят о процентном содержании спирта в смесях (метод Чугаева —Церевитинова — Терентьева).
5. Замещение гидроксильной группы. Гидроксильная группа спиртов способна замещаться галогеном при взаимодействии спиртов: а) с галогеноводородными кислотами, б) с галогенидами фосфора (например, РС13, РОС13, РС15) или в с тионилхлоридом (хлорангидридом сернистой кислоты SOС12).
а) Реакция спиртов с галогеноводородами обратима:
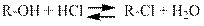
Третичные спирты вступают в эту реакцию значительно легче вторичных и первичных, вторичные — легче первичных. Это объясняется электроноотталкивающим действием алкильных групп (что облегчает отщепление гидроксила) и большей устойчивостью образующегося катиона (благодаря сверхсопряжению) при протекании реакций по механизму Е1.
Гидроксил — трудноуходящая группа. Обычно его переводят действием кислот в оксониевую группировку или действием ацилирующих реагентов — в сложный эфир (ацетат, тозилат). Например:
|
|
|
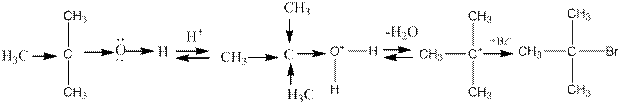
Реакцию галогеноводорода со спиртами часто проводят так, что галогеноводород образуется непосредственно в реакционной среде, например при нагревании спирта с бромидом натрия и серной кислотой:
 С2Н5OН+NaВr+Н2SO4 С2Н5Вr+NaНSO4 + Н2O.
С2Н5OН+NaВr+Н2SO4 С2Н5Вr+NaНSO4 + Н2O.
б) При реакции спиртов с галогенидами фосфора могут получаться в зависимости от условий, как галогенопроизводные, так и эфиры фосфористой кислоты:

В случае применения РС15 последний переходит в хлороксид фосфора, например:
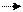 С2Н5ОН+РСl5 С2Н5Сl + НСl + РОСl3.
С2Н5ОН+РСl5 С2Н5Сl + НСl + РОСl3.
в) Реакция с тионилхлоридом идет с образованием алкилхлорида, хлороводорода и диоксида серы:
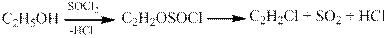
6. Окисление. Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при 300—500 °С такими окислителями, как хромовая смесь, хромовый ангидрид, твердый комплекс Сr03 с пиридином, КМnO4, специально приготовленный диоксид марганца, RO4+NaIO4, Аg2СO3 (осажденный на цеолите) и др.:
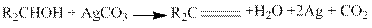
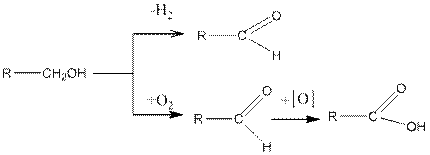
а также дегидрируются при 100—180°С над Си, Аg, Ni, Со, Рt и Рd. Во всех этих случаях первичные спирты дают альдегиды, вторичные — кетоны.
Альдегиды при дальнейшем окислении дают кислоты с тем же числом углеродных атомов. Кетоны могут быть окислены дальше до двух кислот с разрывом углеродной цепи. Третичные спирты окисляются очень трудно с разрывом углеродной цепи и образованием смеси кислот и кетонов:
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1641; Нарушение авторских прав?; Мы поможем в написании вашей работы!