
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественное определение. Неофицинальные реакции
|
|
|
|
Чистота
Избыток
Избыток
Эквив.
Эквив. Белый осадок
Неофицинальные реакции
3. При прокаливании с кобальта нитратом образуется плав цинката кобальта ярко-зеленого цвета - «зелень Ринмана»:
ZnO + Co(NO3)2 → CoZnO2 + 2 NO2↑ + 0,5 O2 ↑
t°
Zn2+ + Co(NO3)2 → CoZnO2 + 2NO2↑
Ярко-зеленый плав
4. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
ZnSO4 + 2NaOH → Zn(OH)2↓ + Na2SO4
ZnSO4 + 2NH4OH → Zn(OH ) 2↓+ (NH4)2SO4
Образуется белый осадок цинка гидроксида, растворимый в избытке раствора натрия гидроксида, в избытке раствора аммиака и в минеральных кислотах (цинка гидроксид проявляет амфотерные и комплексообразующие свойства):
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Zn(OH)2 + 4NH4OH → [Zn(NH3)4](OH)2 + 4Н20
Zn(OH)2 + 2НСl → ZnCl2 + 2Н20
Наличие примесей в оксиде цинка определяется:
способом получения – примесь посторонних металлов и возможная избыточная щелочность, способностью поглощать углекислоту в процессе хранения.
1. Избыточная щелочность определяется добавлением ф/ф к смеси 1г ZnO и 10 мл горячей воды. При появлении розового окрашивания на нейтрализацию должно расходоваться не более 0,3 мл 0,1н. HCI;
2. не допустимая примесь - карбонаты. При добавлении HCI разв. не должно выделяться пузырьков СО2, раствор должен быть прозрачным и бесцветным. При наличии примеси протекает реакция:
ZnCO3 + 2НСl → ZnCl2 + C02↑ + H2O
3. не допустимые примеси Fe3+, Cu2+, Al3+.
При добавлении раствора аммиака раствор должен оставаться б/цв и прозрачным. Соли цинка взаимодействуют с избытком раствора аммиака, образуя растворимые, бесцветные комплексные соединения:
Zn2+ + 4NH4OH → Zn[(NH3)4]2+ + 4Н2O
бесцветный р-р
При наличии примесей протекают реакции:
Fe3+ + 3NH4OH → Fe(OH)3↓ + 3NH4+
|
|
|
красно-коричневый (бурый)
Al3+ + 3NH4OH → Al(OH)3↓ + 3NH4+
белый
Cu2+ + 4NH4OH → [Cu(NH3)4]2+ + 4Н2O
синее окрашивание
Образование гидроксидов железа и алюминия вызывает помутнение раствора; образование аммиаката меди приводит к появлению окраски в испытуемом растворе.
4. не допустимая примесь – Pb. Раствор ZnO в уксусной кислоте после добавления раствора калия хромата должен оставаться прозрачным:
Pb(CH3COO)2 + K2CrO4 → PbCrO4 ↓ + 2 CH3COOK
желтый осадок
хромата свинца
5. допустимая примесь Аs в определенных пределах.
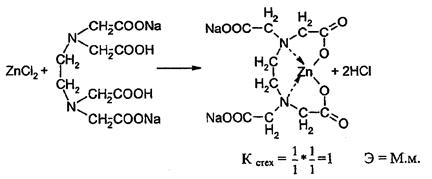
Комплексонометрический метод. Основан на свойстве ионов цинка образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения. Способ прямого титрования. Цинка оксид предварительно растворяют в кислоте хлороводородной.
Используют 2 способа индикации:
1. Титрование проводят в среде аммиачного буфера (рН=9-10) в присутствии индикатора - кислотного хром черного специального.
2. Титрование проводят в присутствии индикатора ксиленолового оранжевого при рН 5-6. Необходимую реакцию среды создают добавлением раствора гексаметилентетрамина.
ZnO + 2HCl → ZnCl2 + H2O
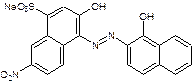 | |||
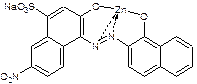 | |||
+Zn+2→
красно-фиолетовый
 fэкв=1
fэкв=1
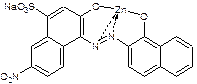
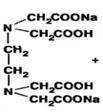
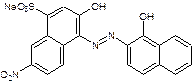
 + Na2ZnTp+2H+
+ Na2ZnTp+2H+
красно-фиолетовый синий
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2984; Нарушение авторских прав?; Мы поможем в написании вашей работы!