
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 6. Решение. Моль – это количество вещества, в ко
|
|
|
|
Пример 5.
Пример 4.
Пример 3.
Выразите в молях:
а) 6,02·1021 молекул СО2;
б) 1,20·1024 атомов кислорода;
в) 2,00·1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02·1023). Отсюда
а) 6,02·1021, т.е. 0,01 моль;
б) 1,20·1024, т.е. 2 моль;
в) 2,00·1023, т.е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
а) 44 г/моль;
б) 18г/моль;
в) 16 г/моль.
Вычислите значение грамм-эквивалента серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г
ЭСа(OH)2 =МСа(OH)2 /2=74/2=37г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение.
Нормальные условия по Международной системе единиц (СИ): давление 1,013·105 Па (760 мм Т. Ст., 1 атм), температура 273 К или 0°С.
Согласно закону эквивалентов
m1/Мэ(1) = m2/Мэ(2)
m(МеО)/Мэ(МеО) = m(Н2)/Мэ(Н2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ(Н2) заменяем равным ему отношением VH2 /VЭ(Н2), где VH2 – объем водорода, VЭ(Н2) эквивалентный объем водорода:
|
|
|
m(МеО)/Мэ(МеО) = V(Н2)/Vэ(Н2)
Находим эквивалентную массу оксида металла МЭ(МеО)
7,09/МЭ(МеО) = 2,24/11,2; МЭ(МеО) = 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов МЭ(МeO) = МЭ(Мe) + МЭ(O2),
отсюда МЭ(Мe) = МЭ(МeО) – МЭ(O2) = 35,45 – 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В,
где: МЭ – эквивалентная масса, г/моль
А – мольная масса металла, г/моль
В – валентность элемента;
А = Мэ·В = 27,45•2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
При 25 0С и давлении93 кПа. (745 мм Т. Ст.) некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0 0С и давлении 101,33 кПа.
Решение.
Подставляя данные задачи в последнее уравнение, получаем:
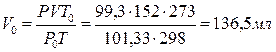
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль
2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3; 17 г/моль.
3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O Ответ: 98 г/моль
Al(OH)3 + 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль
Zn(OH)2 + NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль
4. На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль
|
|
|
5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)). Ответ: 15 г/моль.
6. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3? Ответ: 444г.
7. Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10-22
8. На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
9. Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м3 воздуха. Ответ: 0,295 г.
10. Масса колбы вместимостью 750 мл, наполненной при 27°С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
11. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
12. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген – I.
13. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл – Mg.
14. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите, какой это металл. Ответ: металл – Mg.
15. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %? Ответ: 10,2 г.
16. Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
17. Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu(OH)2, MgCl2. Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
18. На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
19. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ(Ме) = 9 г/моль. Ответ: 0,2 г.
|
|
|
20. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
21. При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160г.
22. Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
23. Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
24. При 25°С и давлении 745 мм Т. Ст. некоторое количество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
25. Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
26. При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
27. Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
28. При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
29. Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74 % и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
30. Масса 0,327 ·10-3 м3 газа, при 13 оС и давлении 1,04 ·105 Па равна 0,828 ·10-3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10-3 кг/моль.
РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Атомы имеют сложное строение. Большой вклад в представление о современной модели атома внесли такие ученые как Дж. Резерфорд, Томпсон, Нильс Бор, де-Бройль и др.
|
|
|
Современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках. Современная модель атома предполагает:
- в центре атома находится положительно заряженное ядро очень малых размеров, в котором сосредоточена почти вся масса атома;
- вокруг ядра послойно вращаются электроны, их число равно заряду ядра;
- электрон может вращаться вокруг ядра не по любым, а только по строго определенным орбитам, причем электрон не излучает электромагнитной энергии, излучение происходит при скачкообразном переходе электрона с одной орбиты на другую.
С этой точки зрения наиболее важным является то, что вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: n – главное квантовое число, l – орбитальное квантовое число, me – магнитное квантовое число, ms – спиновое квантовое число.
Волновая функция электрона зависит от трех квантовых чисел n, l, и m. Индекс n волновой функции электрона в атоме называется главным квантовым числом, характеризующим энергетический уровень электрона. Оно может принимать целочисленные значения от 1, 2, 3,...до ∞. Если n = ∞, то это значит, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома). Число энергетических уровней в атоме равно номеру периода в таблице Д.И. Менделеева, в котором находится элемент.
Орбитальное квантовое число l отражает симметрию пространства, в котором движется электрон. Квантовое число l является мерой орбитального механического момента электрона. Абсолютная величина этого момента зависит от n и может принимать значения: l = n-1.
Волновую функцию электрона в атоме называют атомной орбиталью. В соответствии со значением орбитального квантового числа 1 приняты следующие обозначения атомных орбиталей:
1 = 0 1 2 3 – орбитальное квантовое число;
s p d f – обозначение орбитали.
Для уровня с главным квантовым числом n = 1 возможна 1s-орбиталь, для n = 2 возможны 2s- и 2p-орбитали, для n=3 возможны 3s-, 3p- и 3d-орбитали, для n=4 – (4s-, 4p-, 4d- и 4f) орбитали.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2008; Нарушение авторских прав?; Мы поможем в написании вашей работы!