
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изопроцессы идеального газа
Теплоемкость
Это физическая величина численно равная количеству тепла, которое нужно передать телу, чтобы повысить его температуру на один градус (Кельвин).
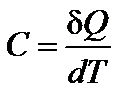
Теплоёмкость моля вещества называется молярной 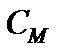 , а единицы массы вещества ‑ удельной c.
, а единицы массы вещества ‑ удельной c.
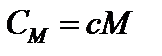 ;
; 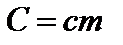 .
.
Рассмотрим процессы нагревания газа в двух цилиндрах. В одном будет постоянным объём, а в другом ‑ давление. По первому закону термодинамики
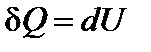 (
(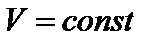 и
и 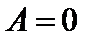 );
);
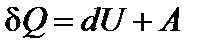 (
(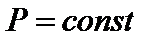 и
и 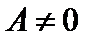 ).
).
В первом случае тепло затрачивается только на нагрев газа. Во втором случае – на нагрев и на совершение работы. Поэтому QV при постоянном объеме меньше, чем QP при постоянном давлении.
Следовательно, теплоемкости газа в этих процессах будут различны. Их обозначают: 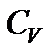 – теплоемкость при постоянном объеме;
– теплоемкость при постоянном объеме; 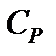 – теплоемкость при постоянном давлении.
– теплоемкость при постоянном давлении. 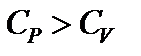 .
.
Если в термодинамическом процессе один из трех параметров (P, V, T) остается постоянным, то процесс называют изопроцессом.
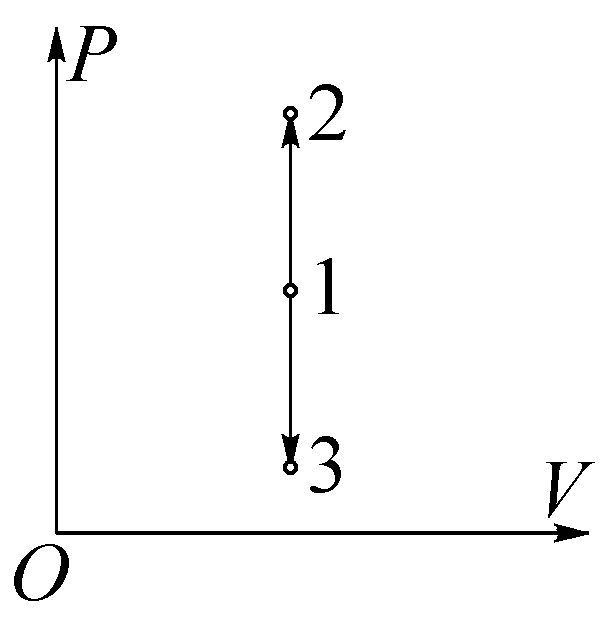 Рис. 28
Рис. 28
|
Следовательно 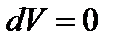 и
и 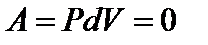 ; График процесса представлен на рис. 28.
; График процесса представлен на рис. 28.
Первый закон термодинамики примет вид 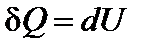
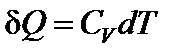 (для изохорного процесса)
(для изохорного процесса)
Тогда 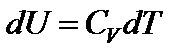
Если 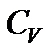 не зависит от температуры, то изменение внутренней энергии в изохорном процессе пропорционально изменению температуры.
не зависит от температуры, то изменение внутренней энергии в изохорном процессе пропорционально изменению температуры.
Для произвольной массы газа 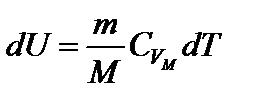 ; Последняя формула справедлива для любого процесса в идеальном газе.
; Последняя формула справедлива для любого процесса в идеальном газе.
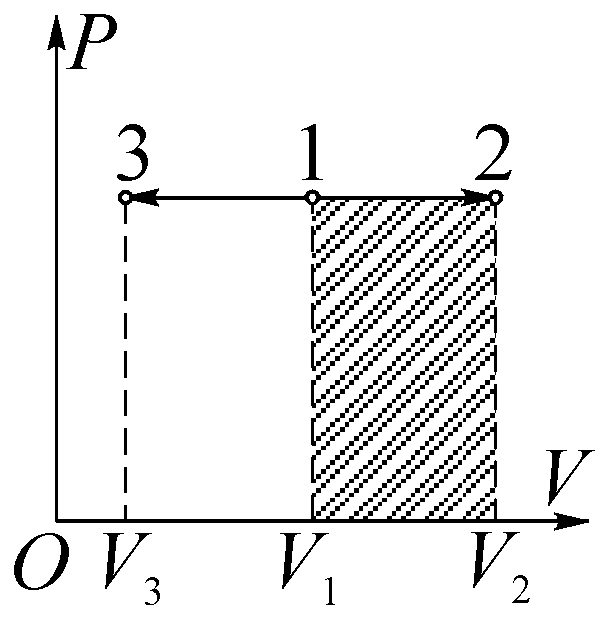 Рис. 29
Рис. 29
|
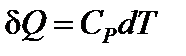 ;
; 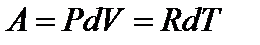 ;
; 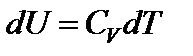 ;
;
Запишем первый закон термодинамики с учетом приведенных формул для одного моля
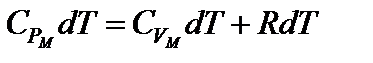
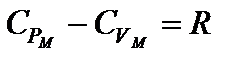 – уравнение Р. Майера
– уравнение Р. Майера
Из этого уравнения следует физический смысл универсальной газовой постоянной R. Она численно равна работе изобарного расширения одного моля идеального газа при нагревании его на один Кельвин.
в) Изотермический процесс (Т = const) (рис. 30). dU = 0;
 Рис. 30
Рис. 30
|
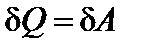 .
.
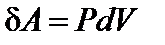 , но
, но 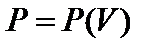 .
.
Тогда 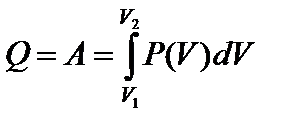
Используя уравнение состояния идеального газа, запишем для одного моля
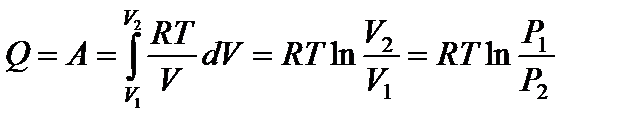 ;
;
Работа расширения газа 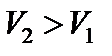 – положительна; работа сжатия газа
– положительна; работа сжатия газа 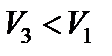 – отрицательна (рис. 29). Теплоемкость вещества в изотермическом процессе бесконечно велика.
– отрицательна (рис. 29). Теплоемкость вещества в изотермическом процессе бесконечно велика.
|
|
Дата добавления: 2014-11-07; Просмотров: 478; Нарушение авторских прав?; Мы поможем в написании вашей работы!