
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выполнение работы. Опыт 1. Приготовление приблизительно 0,1 н
|
|
|
|
Опыт 1. Приготовление приблизительно 0,1 н. раствора соляной кислоты
(Проводить в вытяжном шкафу!). Налить в цилиндр концентрированный раствор соляной кислоты и ареометром определить его плотность.
По измеренной плотности по табл. Б. 2 найти массовую долю (%) кислоты в растворе. Рассчитать массу кислоты, необходимую для приготовления 250 мл 0,1 н. раствора HCl по формуле
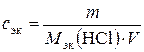 , откуда m = с эк ·М эк (HCl)· V,
, откуда m = с эк ·М эк (HCl)· V,
где с эк – молярная концентрация эквивалентов, моль/л; m – масса кислоты, г; М эк(HCl) – молярная масса эквивалентов кислоты, г/моль; V – объем кислоты, л.
Полученную величину (m) пересчитать на объем, который требуется для приготовления 250 мл 0,1 н. раствора кислоты по формуле
 , откуда V =
, откуда V =  ,
,
где V – объем кислоты, мл; m – масса кислоты,г; ω – массовая доля в % HCl, найденная по табл. Б. 2; ρ – плотность кислоты, г/мл, измеренная ареометром.
Пипеткой отобрать рассчитанный объем раствора кислоты, перенести его в мерную колбу, разбавить водой до метки и хорошо перемешать.
Опыт 2. Установление нормальности и титра кислоты
Отмерить пипеткой 10 мл приготовленного раствора кислоты, перенести его в коническую колбу, добавить 1–2 капли фенолфталеина.
В бюретку налить 0,1 н. раствор NaOH. Оттитровать раствор кислоты. Для этого медленно приливать из бюретки щелочь в колбу с раствором кислоты, непрерывно перемешивая его в процессе титрования. Место, в которое падают капли щелочи, окрашивается в розовый цвет, исчезающий при взбалтывании.. Титрование проводить до тех пор, пока от одной капли щелочи раствор примет неисчезающую окраску. Появление окраски означает, что кислота полностью нейтрализована щелочью. Первое титрование – ориентировочное. Повторить титрование еще три раза. Расхождение между последними тремя титрованиями не должно превышать 0,1 мл.
Требования к результату опыта
Данные опыта занести в табл. 7.1:
Таблица 7.1
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!