
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація білків
|
|
|
|
Структура глобулярних білків.Крім структурних функцій білки виконують різноманітні функції. Серед них одна з головних – каталіз хімічних реакцій, що протікають у клітині. Для здійснення каталітичної (ферментативної)функції білок має зв'язуватися з тривимірним субстратом, тобто місце зв'язування, назване активним центром, повинне бути тривимірним. А це можливо тільки за умови, що сам білок має тривимірну третинну (глобулярну) структуру. Таким чином, відповідність структури і функції, визначає наявність у функціональних білків глобулярної структури. Крім того, глобулярна структура забезпечує розчинність білків у воді (більшість реакцій протікає в цитоплазмі клітини).
Гідрофобні радикали амінокислотних залишків можуть бути заховані усередину глобули, а у воду експоновані направлені гідрофільні залишки. Для забезпечення компактної тривимірної структури білок повинний мати елементи вторинної структури невеликої довжини, з'єднаних неструктурованими ділянками поліпептидного ланцюга. Ці ділянки дозволяють білкові скручуватися в компактну глобулу.
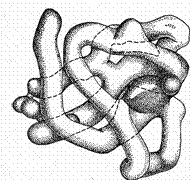
Рис. Глобулярна третинна структура білка міоглобіну.
Третинна структура цілком задається первинною. Визначальними є гідрофобні взаємодії, водневі, дисульфідні, йонні зв¢язки. Гідрофобне ядро існує в більшості білків, гідрофільні групи залишків амінокислот розміщені назовні. Третинна структура є складною, унікальною і специфічною для кожної молекули білка.
Четвертинна структура білка – це агрегація двох або більшого числа поліпептидних ланцюгів, що мають третинну структуру, в олігомерну функціонально значущу композицію. Тобто маємо єдину у структурному та функціональному відношенні одиницю. Білки, що складаються з декількох структурних одиниць називаються олігомерними. Окремі структурні одиниці олігомерного білка називають субодиницями. Взаємне розташування субодиниць, тобто спосіб їхнього спільного укладання й упакування з утворенням нативної конформації олігомерного білка і називають четвертинною структурою. Олігомерний білок може містити дві, три, чотири або більш субодиниць. Іноді зустрічаються олігомери, що складаються з 12 субодиниць. Субодиниці четвертинної структури можуть бути як однаковими, так і різними, розташовуватись у четвертинній структурі як симетрично, так і асиметрично. Зв'язки, що утворюють і підтримують четвертинну структуру, ті ж самі, що і при утворенні третинної структури, крім гідрофобних.
|
|
|
Четвертинну структуру має близько 5% білків, у тому числі гемоглобін, імуноглобулін, інсулін. Майже всі ДНК- і РНК-полімерази мають четвертинну структуру.
І. ПРОСТІ БІЛКИ – побудовані із залишків амінокислот, при гідролізі дають тільки вільні амінокислоти.
1. Протаміни. Сильно лужні білки з невеликою молекулярною масою 60 – 85% аргінін. Добре розчинні у воді
2. Гістони.Білки з основними властивостями – 20 – 30% лізин та аргінін.
Розташовані переважно у ядрі, стабілізують ДНК.
3. Проламіни – розчинність у 60 – 80% водному розчині етанолу, усі інші прості білки за таких умов випадають в осад. Глутамінова кислота – 20 – 25%, пролін – 10 – 15%.
4. Глютеліни розчинні в лужних розчинах (2%-ий розчин NaOH). Склад: глутамін, лізин.
Білки рослинного походження, складають основну масу клейковини зерен злаків.
5. Альбумінирозчинні у воді та розчинах солей. Молекулярна маса: альбумінів – 40000 – 70000.
6. Глобуліни. Молекулярна маса понад 150000.
Найбільше білків у сироватці (плазмі) крові, молока, яєчному білку, м’язах.
Альбуміни та глобуліни – глобулярні білки.
ІІ. СКЛАДНІ БІЛКИ – це двохкомпонентні білки, які складаються із простого білка та небілкової компоненти, яка називається простетичною групою (prosteto - приєдную)
|
|
|
Класифікація складних білків – за природою простетичної групи:
· хромопротеїни – до їх складу входять пігменти;
· металопротеїни – мають метали;
· нуклеопротеїни – мають нуклеінові кислоти;
· ліпопротеїни – мають ліпіди;
· фосфопротеїни – мають фосфорну групу;
· глікопротеїни – вуглевод.
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!