
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість хімічної реакції
ХІМІЧНА РІВНОВАГА
Лабораторна робота №4.
КОНТРОЛЬНІ ПИТАННЯ
Задачі для самостійного розв'язання
1. Чому дорівнює тепловий ефект реакції
СаО(кр) + SO2(r) = CaSO3(Kp),
якщо ΔН 298 (CaSO3)=-1206,87кДж/моль; ΔН °298 (CaO)=-635,6 кДж/моль;
Δ H°298 (SO2)=-296,9 кДж/моль?
2. Обчислити зміну ентропії реакції окислення аміаку: 
якщо ΔS(NH3)=192.5; ΔS(O2)=205.03; ΔS(N2)=199.49; ΔS(H2O)=188.50.
3. Чому дорівнює зміна ентропії реакції
С(тв) + 2Н2О(Г) →СО2(Г) + 2Н2(Г),
якщо С(ТВ) + О2(Г) →СО2(Г); ΔS °= 4 Дж/(моль*К)
Н2(г) + 0,5О2(г) →Н2О(Г); ΔS °= - 43 Дж/(моль*К)?
1. Сформулюйте закон Гесса.
2. Що називають теплотою утворення?
3. Сформулюйте наслідок із закону Гесса.
Мета роботи – навчитися розраховувати константу рівноваги та досліджувати вплив різних факторів на зсув рівноваги хімічних реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
Швидкість хімічної реакції визначається кількістю елементарних актів, що відбуваються за одиницю часу в одиниці об'єму (для гомогенної реакції), або на одиниці поверхні поділу фаз (для гетерогенної реакції):
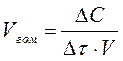

де Vrом, Vгетер - швидкості гомогенної та гетерогенної реакцій; ΔС- зміна концентрації; ΔՇ - проміжок часу; V-об'єм; S - поверхня поділу фаз.
Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин (або продуктів реакції) за одиницю часу. Оскільки перебіг хімічної реакції характеризується безперервною зміною концентрації реагуючих речовин, можна говорити про швидкість хімічної реакції тільки в даний момент часу або про середню швидкість за певний час.
Зміни концентрацій реагуючих речовин знаходяться у
стехіометричній залежності одна від одної, завдяки чому для
визначення швидкості хімічної реакції можна скористуватися
зміною концентрації однієї речовини.
Швидкість реакції залежить від природи реагуючих речовин, їх концентрації, температури, а інколи і від наявності каталізатора.
Залежність швидкості реакції від концентрації реагуючих речовин описується законом діючих мас: швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у ступінях, які дорівнюють стехіометричним коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції:

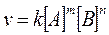
де v - швидкість хімічної реакції; [А] і [В] - концентрація реагуючих речовин; т і п - стехіометричні коефіцієнти; k - коефіцієнт пропорційності, який називається константою швидкості. Наприклад, для реакції


У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації лише тих речовин, які перебувають у газовій фазі або розчині. Наприклад, для реакції горіння вугілля:
С+О2=СО2;
закон діючих мас записується

Збільшення або зменшення тиску газу у декілька разів відповідно збільшує або зменшує його концентрацію у таке само число разів.
Зміна об'єму знаходиться в зворотній пропорційній залежності зі зміною концентрації газів: збільшення об'єму в деяке число разів відповідно зменшує концентрації газів у таке само число разів.
Якщо перебіг хімічної реакції відбувається за рядом проміжних елементарних стадій, то швидкість цієї реакції визначається швидкістю найповільнішої з них.
|
|
Дата добавления: 2014-10-23; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!