
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна рівновага
Хімічні реакції поділяються на оборотні та необоротні.
Необоротні реакції - це хімічні реакції, які перебігають до повної витрати однієї або усіх реагуючих речовин. Оборотні реакції - це хімічні реакції, які при однакових умовах перебігають у протилежних напрямках і при цьому жодна з реагуючих речовин не витрачається повністю.
Наприклад, при однакових умовах можливе одночасне з'єднання азоту та кисню та розклад оксиду азоту, що утворився, на азот та кисень.
Реакція між вихідними речовинами називається прямою реакцією, а реакція між речовинами, що утворилися внаслідок цієї реакції називається зворотною.
При постійному об'ємі концентрації вихідних речовин зменшуються, що супроводжується зменшенням швидкості прямої реакції, а концентрації продуктів реакції - збільшуються, що викликає підвищення швидкості зворотної реакції. Через деякій час швидкості прямої та зворотної реакцій стають однаковими. У цю мить зміна концентрацій вихідних речовин та продуктів реакції припиняється, тобто настає хімічна рівновага. Таким чином, хімічна рівновага - це такий стан системи, при якому швидкості прямої та зворотної реакції однакові. Концентрації речовин, які відповідають стану рівноваги, називаються рівноважними концентраціями. Boни залишаються незмінними.
Наприклад, для системи 2SO2 + О2 = 2SO3, згідно із законом діючих мас, швидкості прямої V1 та зворотної V 2 реакції визначаються за формулами:
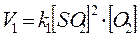
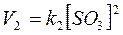
В умовах рівноваги: 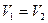 тобто
тобто 
Відношення констант швидкості прямої та зворотної реакцій є сталою величиною, яка називається константою рівноваги даної реакції і дорівнює відношенню добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степені стехіометричних коефіцієнтів. Для наведеної реакції константа рівноваги дорівнює:
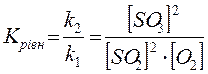
Оскільки швидкість хімічної реакції залежить від температури, і константа рівноваги змінюється при зміні температури. Тому і константа рівноваги є сталою лише при незмінній температурі.
Зміни зовнішніх умов викликають порушення рівноваги, яке знову встановлюється через деякий час. Напрямок зміщення визначається тим, швидкість якої реакції збільшилась у момент порушення рівноваги, або тим, концентрація яких речовин внаслідок зміщення рівноваги стала більшою.
|
|
Дата добавления: 2014-10-23; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!