
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические и коррозионные свойства металлов
|
|
|
|
Гальваническими элементами называют устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую.
Гальванический элемент состоит из двух электродов (катода и анода), погруженных в растворы своих солей. Электроды пространственно отделены друг от друга и соединены между собой металлическим проводником с включенным в него гальванометром. Электролиты соединяются через электрический ключ для обмена анионами.
Устройство медно-цинкового гальванического элемента
(элемента Якоби-Даниэля)
Гальванический элемент Якоби-Даниэля представляет собой два металлических электрода (пластинки цинка и меди) соединенных с гальванометром, погруженные в два отдельных стакана с растворами их собственных солей (1н.раствор ZnSО4 и 1н.раствор CuSО4), соединенных электролитическим ключом (изогнутая стеклянная трубка, заполненная насыщенным раствором хлорида калия в смеси с агар - агаром).

Рисунок 1- Гальванический элемент Якоби-Даниэля
При замыкании электродов через внешнюю цепь, на цинковом электроде пойдет процесс окисления цинка: Zn0 – 2е ® Zn2+.Электроны, образующиеся на цинковом электроде переходят по наружному проводнику к медному электроду, где будут участвовать в процессе восстановления ионов меди:
Cu2+ +2е ® Cu0
Образующиеся ионы Zn2+переходят в раствор и служат переносчиками электрического тока. Суммарная химическая реакция выражается следующей схемой: Zn0 + Cu2+SO4 = Cu0 + Zn2+SO4
Необходимо уметь записывать «Формулу гальванического элемента».
Сначала записывается символ металла (анод), затем ставится черта и пишется формула соли металла с меньшим значением потенциала, образующего анод. Потом, через двойную черту – формулу соли металла, образующего катод, и, через одинарную черту, символ металла, образующего катод.
|
|
|
Например, формула медно-цинкового гальванического элемента (элемента Якоби –Даниэля) будет иметь следующий вид:
-Zn/ZnSO4//CuSO4/Cu+; или в ионной форме -Zn/Zn2+//Cu2+/Cu+
(одиночные вертикальные линии изображают границу металл-раствор, а двойная линия – границу между растворами электролитов).
Важнейшей количественной характеристикой обратимого гальванического элемента является его Э.Д.С. (электродвижущая сила), которую рассчитывают по формуле:
Э.Д.С. = Ек. – Еа., где Ек. и Еа. – электродные потенциалы катода и анода. Их стандартные величины даны в справочниках.
Стандартные электродные потенциалы – это Э.Д.С. металла, измеренная при н.у. (Т = 298К, Р – 1,01· 105 Па) при опускании пластины этого металла, погруженной в раствор его соли, содержащей 1 моль ионов металла на 100г и соединенной с водородным электродом.
Таблица 2 - Стандартные электродные потенциалы при 25o С.
| Электрод | Электродная реакция | Eo, В |
| Li+/Li | Li+ + e = Li | -3.045 |
| K+/K | K+ + e = K | -2.925 |
| Ba2+/Ba | Ba2+ + 2e = Ba | -2.906 |
| Ca2+/Ca | Ca2+ + 2e = Ca | -2.866 |
| Na+/Na | Na+ + e = Na | -2.714 |
| La3+/La | La3+ + 3e = La | -2.522 |
| Mg2+/Mg | Mg2+ + 2e = Mg | -2.363 |
| Be2+/Be | Be2+ + 2e = Be | -1.847 |
| A13+/A1 | Al3+ + 3e = Al | -1.662 |
| Ti2+/Ti | Ti2+ + 2e = Ti | -1.628 |
| Zr4+/Zr | Zr4+ + 4e = Zr | -1.529 |
| V2+/V | V2+ + 2e = V | -1.186 |
| Mn2+/Mn | Mn2+ + 2e = Mn | -1.180 |
| WO42-/W | WO42- + 4H2O + 6e = W + 8OH- | -1.05 |
| Se2-/Se | Se + 2e = Se2- | -0.77 |
| Zn2+/Zn | Zn2+ + 2e = Zn | -0.763 |
| Cr3+/Cr | Cr3+ + 3e = Cr | -0.744 |
| Ga3+/Ga | Ga3+ + 3e = Ga | -0.529 |
| S2-/S | S + 2e = S2- | -0.51 |
| Fe2+/Fe | Fe2+ + 2e = Fe | -0.440 |
| Cr3+,Cr2+/Pt | Cr3+ + e = Cr2+ | -0.408 |
| Cd2+/Cd | Cd2+ + 2e = Cd | -0.403 |
| Ti3+, Ti2+/Pt | Ti3+ + e = Ti2+ | -0.369 |
| Tl+/Tl | Tl+ + e = Tl | -0.3363 |
| Co2+/Co | Co2+ + 2e = Co | -0.277 |
| Ni2+/Ni | Ni2+ + 2e = Ni | -0.250 |
| Mo3+/Mo | Mo3+ + 3e = Mo | -0.20 |
| Sn2+/Sn | Sn2+ + 2e = Sn | -0.136 |
| Pb2+/Pb | Pb2+ + 2e = Pb | -0.126 |
| Ti4+, Ti3+/Pt | Ti4+ +e = Ti3+ | -0.04 |
| D+/D2, Pt | D+ + e = 1/2 D2 | -0.0034 |
| H+/H2, Pt | H+ + e = 1/2 H2 | 0.000 |
| Ge2+/Ge | Ge2+ + 2e = Ge | +0.01 |
| Br-/AgBr/Ag | AgBr + e = Ag + Br- | +0.0732 |
| Sn4+, Sn2+/Pt | Sn4+ + 2e = Sn2+ | +0.15 |
| Cu2+, Cu+/Pt | Cu2+ + e = Cu+ | +0.153 |
| Cu2+/Cu | Cu2+ + 2e = Cu | +0.337 |
| Fe(CN)64-, Fe(CN)63-/Pt | Fe(CN)63- + e = Fe(CN)64- | +0.36 |
| OH-/O2, Pt | l/2 O2 + H2O + 2e = 2OH- | +0.401 |
| Cu+/Cu | Cu+ + e = Cu | +0.521 |
| J-/J2, Pt | J2 + 2e = 2J- | +0.5355 |
| Te4+/Te | Te4+ + 4e = Te | +0.56 |
| MnO4-, MnO42-/Pt | MnO4- + e = MnO42- | +0.564 |
| Rh2+/Rh | Rh2+/Rh | +0.60 |
| Fe3+, Fe2+/Pt | Fe3+ + e = Fe2+ | +0.771 |
| Hg22+/Hg | Hg22+ + 2e = 2Hg | +0.788 |
| Ag+/Ag | Ag+ + e = Ag | +0.7991 |
| Hg2+/Hg | Hg2+ + 2e = Hg | +0.854 |
| Hg2+, Hg+/Pt | Hg2+ + e = Hg+ | +0.91 |
| Pd2+/Pd | Pd2+ + 2e = Pd | +0.987 |
| Br-/Br2, Pt | Br2 + 2e = 2Br- | +1.0652 |
| Pt2+/Pt | Pt2+ + 2e = Pt | +1.2 |
| Mn2+, H+/MnO2, Pt | MnO2 + 4H+ + 2e = Mn2+ + 2H2O | +1.23 |
| Cr3+, Cr2O72-, H+/Pt | Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | +1.33 |
| Tl3+, Tl+/Pt | Tl3+ + 2e = Tl+ | +1.25 |
| Cl-/Cl2, Pt | Cl2 + 2e = 2Cl- | +1.3595 |
| Pb2+, H+/PbO2, Pt | PbO2 + 4H+ + 2e = Pb2+ + 2H2O | +1.455 |
| Au3+/Au | Au3+ + 3e = Au | +1.498 |
| MnO4-, H+/MnO2, Pt | MnO4- + 4H+ + 3e = MnO2 + 2H2O | +1.695 |
| Ce4+, Ce3+/Pt | Ce4+ + e = Ce3+ | +1.61 |
| SO42-,H+/PbSO4, PbO2, Pb | PbO2 + SO42- + 4H+ + 2e = PbSO4 + 2H2O | +1.682 |
| Au+/Au | Au+ + e = Au | +1.691 |
| H-/H2, Pt | H2 + 2e = 2H- | +2.2 |
| F-/F2, Pt | F2 + 2e = 2F- | +2.87 |
ЭДС элемента связана с 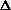 G протекающей в элементе реакции:
G протекающей в элементе реакции:
|
|
|
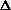 G = - nFE.
G = - nFE.
Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
 .
.
Константа равновесия реакции, протекающей в элементе Даниэля, равна
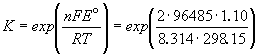 = 1.54. 1037.
= 1.54. 1037.
Зная температурный коэффициент ЭДС  , можно найти другие термодинамические функции:
, можно найти другие термодинамические функции:
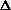 S =
S = 
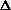 H =
H = 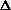 G + T
G + T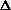 S = - nFE +
S = - nFE +  .
.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 813; Нарушение авторских прав?; Мы поможем в написании вашей работы!