
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный анализ
|
|
|
|
Хром
Медь
Цинк
Железо
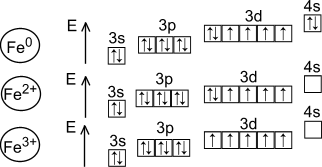
Железо находится в побочной подгруппе VIII группы Периодической системы. Строение электронной оболочки атома: 3d64s2.
1s22s22p63s23p63d64s2
Атомы железа проявляют степень окисления +2 и +3.
Железо является одним из самых распространенных элементов в природе, массовая доля в земной коре – 5,1%. Железо входит в состав большинства горных пород. Основными железными рудами являются магнитный железняк, бурый железняк и красный железняк.
Свойства. Железо – серебристо-белый металл. На воздухе подвергается коррозии, покрываясь ржавчиной. Чистое железо достаточно мягкое и пластичное. Температура плавления 1539°С. В интервале температур 910-1390°С железо образует кубическую гранецентрированную решетку. Железо является достаточно хим.активным металлом.
1. Взаимодействие с неметаллами. При нагревание железо реагирует с многими неметаллами: Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
2. Взаимодействие с водой. Железо взаимодействует с водой лишь при высоких температурах (свыше 700°С):
3Fe + 4H2O = Fe3O4 + 4H
3. Взаимодействие с кислотами. Железо растворяется в хлороводородной и разбавленной серной кислотах, образуя соли железа (II) и водород:
Fe + H2SO4 = FeSO4 + H2
В достаточно концентрированной серной кислоте реакция просекает по уравнению:
Fe + 2H2SO4 = FeSO4 + SO2 + 2H2O
В серной кислоте очень высокой концентрации железо пассивирует. С разбавленной азотной кислотой железо взаимодействует. Продукты взаимодействия в зависимости от концентрации кислоты могут быть различными. В концентрированной азотной кислоте железо пассивирует.
4. Взаимодействие с солями. Железо может вытеснять некоторые металлы из растворов их солей:
|
|
|
Fe + CuSO4 = FeSO4 + Cu
5. Взаимодействие с оксидом углерода (II). Железо, взаимодействуя с этим оксидом, образует пентокарбонил железа:
Fe + 5CO = [Fe(CO)5]
Оксид железа (II) и гидроксид железа (II) – вещества основного характера, легко взаимодействуют с кислотами:
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Оксид железа (II) можно получить, восстанавливая оксид железа (III) водородом:
Fe2O3 + H2 = 2FeO + H2O
Гидроксид железа (II) образуется при действии щелочей на растворы солей железа (II):
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Реакция должна протекать без доступа воздуха. В противном случае гидроксид железа (II) окисляется до гидроксида железа (III). Оксид и гидроксид железа (III) проявляют амфотерные свойства, они взаимодействуют с кислотами и с щелочами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe(OH)3 + 3KOH = K3[Fe(OH)6]
Fe2O3 + 2KFeO2 + H2O
Соли железа (II) под действием окислителей проявляют восстановительные свойства. Соли железа (III) – слабые окислители.
Железо и его соединения имеют большое значение для народного хозяйства. Сплавы железа с углеродом и другими веществами – стали являются основными конструкционными материалами. В хим. промышленности железо используют как катализатор.
Цинк находится в побочной подгруппе II группы. Атомы элементов этой подгруппы имеют следующую электронную оболочку: (n-1)s2p6d10ns2. Проявляют в соединениях степень окисления +2.
Цинк – серебристо-белый металл. Обладает хорошей электро- и теплопроводимостью. На воздухе цинк покрывается защитной пленкой оксидов и гидроксидов, которая ослабляет его металлический блеск.
Цинк – химически активный металл. При нагревании легко взаимодействует с неметаллами (серой, хлором, кислородом):
2Zn + O2 = 2ZnO
Растворяется в разбавленных и концентрированных кислотах HCl, H2SO4, HNO3 и в водных растворах щелочей:
Zn + 2HCl = ZnCl2 + H2
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Оксид цинка – белое вещество, практически нерастворимое в воде. Оксид и гидроксид цинка являются амфотерными соединениями; они реагируют с кислотами и щелочами:
|
|
|
ZnO +2HCl = ZnCl2 + H2O
ZnO + 2KOH + H2O = K2[Zn(OH)4]
Гидроксид цинка растворяется в водном растворе аммиака, образуя комплексное соединение:
Zn(OH)2 + 6NH3 = [Zn(NH3)6](OH)2
При получение цинка его руды подвергают обжигу:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnCO3 = ZnO + CO2
Далее оксид цинка восстанавливают углем:
ZnO + C = Zn + CO
Для получения более чистого металла оксид цинка растворяют в серной кислоте и выделяют электролизом.
Цинк используют для производства сплавов. Цинком покрывают стальные и чугунные изделия для защиты их от коррозии.
Медь находится в побочной подгруппе I группы Периодической системы. Строение электронных оболочек атомов элементов этой подгруппы выражается формулой (n-1)d10ns1. На внешнем энергетическом уровне атома находится один электрон, однако в образовании хим. связей могут принимать участие и электроны с d-подуровня предпоследнего уровня. Поэтому они могут проявлять степени окисления +1, +2, +3, для меди наиболее устойчивы соединения со степенью окисления +2.
Медь – мягкий пластичный металл, имеет розово-красную окраску. Обладает высокой электрической проводимостью.
Медь – химически малоактивный металл. С кислородом реагирует только при нагревании:
2Cu + O2 = 2CuO
Не реагирует с водой, растворами щелочей, хлороводородной и разбавленной серной кислотами. Медь растворяется в кислотах, являющихся сильными окислителями:
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 +2H2O
Во влажной атмосфере, содержащей диоксид углерода, поверхность меди обычно покрывается зеленоватым налетом основного карбоната меди:
2Cu + O2 + CO2 +H2O = Cu(OH)2 ∙ CuCO3
Оксид меди (II) CuO – черное вещество, может быть получен из простых веществ или путем нагревания гидроксида меди (II):
Cu(OH)2 = CuO + H2O
Гидроксид меди (II) представляет собой малорастворимое в воде соединение голубого цвета. Легко растворяется в кислотах и при нагревании в концентрированных растворах щелочей, т.е. проявляет свойства амфотерного гидроксида:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2KOH = K2[Cu(OH)4]
Основная масса производимой меди используется в электротехнической промышленности. В больших количествах медь идет на производство сплавов.
|
|
|
Хром находится в побочной подгруппе VI группы Периодической системы. Строение электронной оболочки хрома: Cr3d54s1.
Таблица 20 – Характеристика элемента Сr
| Атомный номер | Название | Электронная конфигурация | г/см3 | tпл. C | tкип. C | ЭО | Атомный радиус, нм | Степень окисления |
| Хром Cr | [Ar] 3d54s1 | 7,2 | 1,56 | 0,125 | +1,+2,+3, +4,+5,+6 |
Массовая доля хрома в земной коре составляет 0,02%. Важнейшими минералами, входящими в состав хромовых руд, являются хромит, или хромистый железняк, и его разновидности, в которых железо частично заменено на магний, а хром – на алюминий.
Хром – серебристо серый металл. Чистый хром достаточно пластичный, а технический самый твердый из всех металлов.
Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором:
4Cr + 3O2 –t°→ 2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В азотной и концентрированной серной кислотах он пассивирует, покрываясь защитной оксидной пленкой. В хлороводородной и разбавленной серной кислотах растворяется, при этом, если кислота полностью освобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекает на воздухе – соли хрома (III):
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3H2O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(NH4)2Cr2O7 –t°→ Cr2O3 + N2+ 4H2O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
|
|
|
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
Cr2O3 + 6KHSO4 → Cr2(SO4)3 + 3K2SO4 + 3H2O
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3 → 2K2Cr2O7(дихромат калия) + KCl + 2H2O
Гидроксид хрома (III) Cr(OH)3 - нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH →2Cr(OH)3Ї + 3Na2SO4
Обладает амфотерными свойствами - растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH → K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH → KCrO2(хромат калия) + 2H2O)
Оксид хрома (VI) CrO3 - ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
CrO3 - кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
| кислая среда | ||
| 2CrO42- + 2H+ | ←–––––––––––– ––––––––––––→ | Cr2O72- + H2O |
| щелочная среда |
Все соединения хрома (VI) - сильные окислители.
4CrO3 + 3S → 3SO2 + 2Cr2O3 через амфотерные к кислотным (- основной, - амфотерный, - аллы проявляют свою высшую степень окисления, изменяются от основны
Задания для контроля усвоения темы
1. Напишите уравнения следующих реакций:
1) H2SO4 + Zn →; 2)Na + H2 →; 3) Al + NaOH →; 4) CuSO4 + Zn →;
5) Ba + H2O →; 6) Cu + H2SO4 конц. →; 7) Mg + HNO3 конц. →;
8) Al + O2 →; 9) Al(OH)3 + NaOH →; 10) KOH + ZnSO4 →;
11) Ca(OH)2 + CO2 →;12) Al2S3 + H2O →; 13) Al + Cl2 →; 14) Na + H2O→ 15) Al + HNO3 →
2. Напишите уравнения реакции растворения Al(OH)3 и Cr(OH)3 в расплаве и растворе NaOH.
3. Какой процесс называется алюмотермией? Приведите соответствующие данному процессу уравнения реакции.
4. Из какого металла изготавливают нить накала в лампах. Почему?
5. В радиотехнике при изготовлении печатных плат производят травление медных пластин хлоридом железа (III). Напишите уравнение этой химической реакции.
6. Напишите уравнения химических реакций протекающих при осуществлении следующих процессов: 1) NaCl → Na → NaOH → Na2CO3 → NaHCO3 → NaCl; 2) BaCl2 → Ba → BaO → (Ba(OH)2 → BaCO3 → Ba(HCO3)2 → BaCO3→ → BaCl2;
3) ZnCO3 → ZnCl2 → ZnSO4 → Zn(OH)2 → Na2ZnO2; 4) Ca(HCO3)2 → CaCO3 → CaO → Ca(OH)2 → Ca(HCO3)2; 5) Mg → MgSO4 → Mg(NO3)2 → MgO → (CH3COO)2Mg; 6) Mn → MnSO4 → MnO → MnO2 → КMnO4 → MnSO4;
7) Fe2O3 → FeO → FeCl2 → FeCl3 → Fe(OH)3 → Fe2O3; 8) CaCO3 → CaO → Ca(OH)2 → CaCO3 → Ca(NO3)2; 9) HgSO4 → HgO → HgCl2 → Hg → Нg(NO3)2 → HgCl2; 10) Cr→CrSO4→Cr2(SO4)3→Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7→→Cr2O3;
11) Al→Al2O3→AlCl3→Al(OH)3→Na3[Al(OH)6]; 12) CuCl2→Cu→Cu(NO3)2→Cu(OH)2→CuO; 13) CaC2→Ca(OH)2→CaCO3→CaO→CaCl2→Ca; 14) Mg→MgS→MgO→Mg(OH)2→MgSO4→Mg(NO3)2→MgO; 15) Al3C4→Al(OH)3→Al2O3→NaAlO2→Al(OH)3→K[Al(OH)4];
7. Почему электроды для электродуги в пламени атомарного водорода нельзя делать из платины?
8. Специальная сталь высшего качества, применяемая для резки металла (резцы, фрезы, сверла и т.д.) имеет состав: 0,7% углерода; 20% вольфрама;1,5% ванадия; 0,5% марганца и 5% хрома. Какие соли перечисленных элементов и в каком количестве будут получены при сплавлении 10 г порошка этой стали с гидрооксидом калия в присутствии сильного окислителя?
Задания с профессиональной направленностью
16. Подземные воды, используемые для полива огородов, сада, бахчевых культур, часто содержат растворимый бесцветный гидрокарбонат железа (II). При перемешивании и естественном нагревании поливная вода приобретает окраску, затем выпадает осадок. Выразите происходящие явления уравнениями реакций. Объясните, почему в подземных условиях стабильны состояния железа (II).
17. Составьте уравнения реакций, которые соответствуют превращениям сульфата цинка в почве, имеющей щелочную среду. Процесс идет в несколько стадий.
18. При выращивании саженцев в лесных питомниках применяют микроэлементы на фоне азотных удобрений. Зная, что усвоение цинка на кислых почвах значительно выше, чем на щелочных, объясните возможность использования для внекорневой подкормки саженцев березы раствора смеси солей сульфата аммония и сульфата цинка.
19. Усвоение меди лучше происходит на кислых почвах. Объясните, почему одновременное внесение сульфата меди и извести уменьшает возможность усвоения меди.
20. Для совместного внесения в почву микроэлементов железа и меди приготовили 800г 2-х процентного раствора СuSО4. Затем в раствор погрузили: а) 2 г; б) 5,6 г; в) 7г железных опилок. В каком из полученных растворов одновременно содержатся катионы Сu+2 и Fе +2. Ответ подтвердите расчетами.
21. В сельском хозяйстве железный купорос используют как пестицид, который на воздухе постепенно выветривается и окисляется с поверхности, переходя в желто - бурую основную соль железа (III). Напишите уравнение реакции и рассчитайте массу железного купороса, если масса основной соли составляет 84,5 г.
22. В состав гранулированных минеральных удобрений, содержащих основные элементы питания растений, вводят небольшие добавки (не более 0,1% железного купороса). Рассчитайте массу железа, необходимую для получения 1кг удобрения.
23. При обработке смородины бордоской жидкостью на площади 2 сотки для приготовления раствора (стойкой суспензии) использовали медный купорос и гашеную известь в соотношении 1:0,75. Рассчитайте норму расхода на 1 га по медному купоросу, если известь взята массой 0,225.
24. Для опрыскивания плодовых деревьев и ягодных кустарников применяют 1%-ный раствор сульфата меди (II).Рассчитайте массу медного купороса, необходимую для приготовления 500 г раствора.
25. Для дезинфекции механических повреждений плодово-ягодных культур используют ≈ 1%-ный раствор сульфата меди. Рассчитайте массу медного купороса, необходимую для приготовления 2 л раствора с плотностью 1,03 г/ мл.
26. Для профилактики грибкового заболевания пионов, растения опрыскивают раствором гипохлорита меди с массовой долей Сu (ОСl)2 0,5 %. Рассчитайте массу катионов меди в растворе Сu(ОСl)2,взятом массой 2 кг.
27. В течение вегетации на 4 сотках была проведена трехкратная обработка картофеля бордоской жидкостью. Для приготовления стойкой суспензии израсходовано 0,3 кг гашеной извести на однократную обработку 1 га. Рассчитайте массу ионов меди, необходимую для полной обработки, если соотношение медного купороса и извести в смеси 1: 0,75.
28. Сульфат цинка в малых дозах является минеральной подкормкой плодово – ягодных культур. Сульфат цинка массой 32,2 г растворили в воде и довели объем раствора до 1 л. в полученном растворе концентрация ионов цинка 0,19 моль/л. рассчитайте степень диссоциации сульфата цинка.
29. Цинк вводят в простой и двойной суперфосфаты и аммофос для улучшения действия этих удобрений. Рассчитайте массу ионов цинка, полученных в результате обработки оксида цинка кислотами, если в 1 кг двойного суперфосфата находится 5 % оксида цинка.
30. Сульфат цинка в малых дозах является минеральной подкормкой. При взаимодействии 32,5 г загрязненной цинковой стружки с серной кислотой выделилось 4,8 л водорода (н.у.). Рассчитайте степень загрязнения.
4.10 Раздел: основы химического анализа
Цель: изучить методы химического анализа
Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. Практической задачей аналитической химии является установление химического состава веществ или их смесей. Сначала устанавливают качественный состава вещества, т.е. решают вопрос, из каких элементов, групп элементов или ионов состоит это вещество, а затем приступают к определению количественного состава: узнают, в каких количественных соотношениях обнаруженные составные части находятся в данном веществе.
Обнаружение или "открытие" отдельных элементов или ионов, входящих в состав вещества, является задачей качественного анализа.
Определение количественного содержания отдельных составных частей исследуемого вещества является задачей количественного анализа.
Аналитическая химия и, в частности, качественный анализ имеют огромное научное и практическое значение, представляя совокупность методов исследования веществ и их превращений. Важнейшую роль она играет также и в смежных с химией областях науки – минералогии, геологии, физиологии, микробиологии, а также в медицинских, агрономических и технических науках. Почти при всяком научном исследовании, так или иначе соприкасающемся с химическими явлениями, приходится пользоваться методами аналитической химии.
Основные понятия
С помощью специфических реакций, т.е. реакций, характерных только для одного какого-то иона, можно открывать этот ион в присутствии других ионов. Однако таких реакций известно сравнительно немного. Чаще всего реактив дает одинаковый эффект с несколькими ионами, что лишает аналитика возможности сделать однозначное заключение о составе вещества. В этих случаях приходится прибегать прежде всего к разделению мешающих ионов, а затем уже к их открытию.
Для разделения ионов используют осаждение труднорастворимых соединений, реакции окисления – восстановления, комплексообразования, экстракции и другие методы.
Реактив, с помощью которого выделяют в осадок (или переводят в раствор) отдельные группы ионов, называют групповым реагентом. В качестве групповых можно использовать не все реактивы. Групповой реагент должен удовлетворять следующим требованиям: а) осаждать ионы практически количественно; б) полученный осадок должен легко растворятся в кислотах, чтобы можно было продолжить анализ; в) избыток добавленного реагента не должен мешать обнаружению тех ионов, которые остались в растворе.
Дробный анализ состоит в обнаружении ионов данного элемента в отдельных порциях раствора без предварительного разделения смеси ионов на группы. Дробный анализ выполняется в произвольной последовательности. Для обнаружения ионов дробным способом используют наиболее характерные реакции, специфичность и чувствительность которых повышают созданием оптимальных условий анализа (рН, температура, маскировка мешающих ионов, экстракция и т.п.) Дробный анализ может быть выполнен с использованием капельного, микрокристаллоскопического, хроматографического методов, реакций между твердыми веществами и т.д.
Отсутствие специфических реакций на большинство ионов приводит к необходимости предварительного разделения ионов и устранения мешающего действия посторонних веществ. Этим целям служит систематический ход анализа, который представляет собой определенную последовательность аналитических реакций, при которых каждый ион открывают после того, как будут открыты и удалены все другие ионы, мешающие его обнаружению.
Для удобства обнаружения, ионы делятся на аналитические группы. При объединении ионов в группы используют сходство или различие их свойств в отношении действия некоторых реактивов, называемых групповыми, различную растворимость образуемых ими соединений и другие признаки.
Наименьшее содержание определяемого компонента (Сх), при котором его можно обнаружить данным методом с заданной доверительной вероятностью (Р), называют пределом обнаружения. Пусть предел обнаружения равен 10-4 г и Р = 0,95. Это означает, что при содержании 10-4 г определяемого компонента в анализируемой пробе в 95 опытах из 100 получают правильный результат, т.е. обнаруживают искомый компонент. Если Сх > 10-4 г, то вероятность обнаружения становится выше. Если содержание вещества в пробе меньше предела обнаружения, то его нельзя обнаружить данным методом. Аналитическая реакция тем чувствительнее, чем ниже предел обнаружения. Предел обнаружения зависит от концентрации реагентов, присутствия посторонних ионов, электролитов или мешающих веществ, среды и температуры растворов. Его можно повысить с помощью приемов концентрирования, понижения растворимости осадка.
Аналитическая классификация ионов
В настоящее время существуют пять методов классификации ионов. Это сероводородный, аммиачно-фосфатный, дифталатный, тиоацетамидный и кислотно-основной методы. Сероводородный метод основан на различной растворимости сульфидов, хлоридов и карбонатов. В дифталатном методе для разделения групп ионов используют дифталат калия с гидроксидом калия или натрия. Тиоацетамидный метод основан на применении в качестве группового реагента тиоацетамида, хлороводородной кислоты и карбоната аммония. В кислотно-основном методе основными реагентами являются кислоты HCl и H2SO4, гидроксиды калия и натрия и водный раствор аммиака. В настоящей работе более подробно рассматривается аммиачно-фосфатный метод, который отличается простотой, не требует дорогостоящих и токсичных реактивов и легко усваивается студентами.
Классификация катионов по аммиачно-фосфатному методу
В аммиачно-фосфатном методе все катионы делятся на 5 групп на основании различной растворимости фосфатов и гидроксидов в водной и водно-аммиачной среде.
1 группа: K+, Na+, NH4+
Катионы 1-ой группы не имеют группового реагента, их фосфаты растворимы в воде.
2 группа состоит из двух подгрупп:
а) Mg2+, Ca2+, Sr2+, Ba2+, Mn2+, Fe2+
б) Fe3+, Al3+, Cr3+, Bi3+
Катионы 2-ой группы образуют с растворимыми фосфатами (гидрофосфатом аммония (NH4)2HPO4) малорастворимые в воде и растворе аммиака соединения. Фосфаты катионов 2а подгруппы растворимы в уксусной кислоте, фосфаты катионов 2б группы не растворяются в уксусной, но переходят в раствор при обработке раствором хлороводородной кислоты.
3 группа: Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Hg2+
Катионы 3-ей группы в водном растворе аммиака в присутствии фосфат-ионов образуют растворимые аммиачные комплексы [Me(NH3)4]2+.
4 группа: Sn (IV), Sn (II), Sb (V), As (V)
В азотнокислой среде катионы 4-ой группы образуют малорастворимые кислоты H2SnO3, H2SnO2, HSbO3, H3AsO4.
5 группа: Ag+, Pb2+, Hg22+
С хлороводородной кислотой катионы 5-ой группы образуют малорастворимые хлориды.
Аналитическая классификация анионов
Анионы делятся на 3 аналитические группы.
1 группа: SO42-, SO32-, S2O32-, CO32-, PO43-, F-, SiO32-
Групповой реагент на 1 группу анионов – хлорид бария.
2 группа: Cl-, Br-, I-, S2-
Групповой реагент на 2 группу анионов – нитрат серебра.
3 группа: NO3-, NO2-, CH3COO-
На анионы третьей группы нет группового реагента.
Методы количественного анализа:
· химические методы анализа.
· гравиметрический (весовой) анализ;
· титриметрический (объемный) анализ;
· газоволюметрический анализ;
· физические методы анализа;
· физико-химические методы анализа.
Любой метод анализа использует определенный аналитический сигнал, который в данных условиях дают конкретные элементарные объекты.
Например, образование сульфата бария при взаимодействии растворов, содержащих ионы бария и сульфат-ионы, есть аналитический сигнал.
Аналитический сигнал дает информацию как качественного, так и количественного характера.
Под качественной информацией понимают сведения о том, какие элементарные объекты вызывают данный сигнал.
Количественную информацию дает интенсивность сигнала. Чем больше интенсивность сигнала, тем больше в анализируемом веществе (материале) элементарных объектов, вызывающих этот сигнал.
В гравиметрическом анализе интенсивностью аналитического сигнала является масса высушенного или прокаленного осадка, в титриметрическом – объем раствора, израсходованный на реакцию, в фотометрическом - интенсивность окраски раствора (оптическая плотность) и т.д.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1735; Нарушение авторских прав?; Мы поможем в написании вашей работы!