
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 1 страница
|
|
|
|
Негізгі әдебиеттер тізімі:
- Бірімжанов Б, Нурахметов Н, Жалпы химия, Алматы, Ана тілі, 1992ж. – 624б.
- Аханбаев К, Жалпы анорганикалық химия, Алматы, 1999ж, -558б.
- Коровин Н.В. Общая химия – М.: «Высшая школаң, 2003г. – 557с.
- Павлов Н.Н. Общая и неорганическая химия. – М.: «Дрофаң, 2002г. – 448с.
- Зубович И.А. Неорганическая химия – М.: «Высшая школаң, 1989г. – 432с.
- Гельфман М.И., Юстратов В.П. Химия – СПб.: «Ланьң, 2003г. – 480с.
Қосымша әдебиеттер тізімі:
- Глинка Н.Л. Общая химия. - М.: «Интеграл-Прессң, 2002г. – 728с.
- Хомченко И.Г. Общая химия. – М.: «Новая волнаң, 2002г. – 464с.
- Романцева Л.М. и др. Сборник задач и упражнений по общей химии. – М.: «Высшая школаң, 1991г. – 43с.
- Васильева З.Г. и др. Лабораторные работы по общей и неорганической химии. – Л.: «Химияң, 1986г. – 288с.
- Айтхожаева Е.А., Маканов У.М. Методические указания по общей химии при модульном обучении. – Алматы: КазНТУ, 1994г. – 43с.
- Айтхожаева Е.А., Модульное обучение по неорганической химии. Методические указания. Алматы: КазНТУ, 2003г. – 45с.
1.8 Білімді бақылау және бағалау
Қ.И.Сәтбаев атындағы ҚазҰТУ семестр кезінде студенттің оқу жұмысын жүйелік және қалыпты бақылаумен қамтамасыз ету үшін білімнің рейтингтік бақылауы қолданылады.
Пәннің қосынды қорытынды рейтингі 100 балға тең. Емтихан (сессия кезінде) қорытынды бақылау болып табылады, ол максималды 40 балмен бағаланады.
Семестр кезінде 2 рубеждік тестік бақылау бақылау (сегізінші және он бесінші аптада) жүргізіледі, ол 10 баллмен бағаланады.
Ағымдық бақылауды студенттің білімінің бағасына 10 лабораториялық жұмыстың орындалуы (бұл жұмыстың көлемі мен күрделілігіне байланысты 2-3 балмен бағаланады) және модулдар бойынша 5 жазба өзіндік жұмыс (3 балл бойынша) кіреді.
|
|
|
Ағымдық бақылаудың нәтижелерін тапсыру уақыты оқу процесінің (3-кесте) күнтізбелік кестесінде келтірілген.
4 кесте
Оқу процесінің күнтізбелік кестесі
«Химияң пәні бойынша
| Апталар | |||||||||||||||
| Бақылау түрлері | Л-1 | Л-2 | Б-1 | ӨЖ-І | ӨТ-1 | Л-3 | Л-4 | Л-5 | Б-2 | Л-6 | Б-3 | ӨТ-2 | Л-7 | Л-8 | ӨЖ-2 |
| Балл |
Л -лабораториялы
Жумыс.
Б -бакылау
А.Б- аралык
бакылау
Кл-коллоквиум
4-кесте
Студенттердің білімдерін бағалау
| Баға | Әріптік эквивалент | Рейтингтік балл (пайызбен %) | Балмен |
| Өте жақсы | А А- | 95-100 90-94 | 3,67 |
| Жақсы | В+ В В- | 85-89 80-84 75-79 | 3,33 3,0 2,67 |
| Қанағаттанарлық | С+ С С- D+ D- | 70-74 65-69 60-64 55-59 50-54 | 2,33 2,0 1,67 1,33 1,0 |
| Қанағаттанарлықсыз | Ғ | 0-49 |
1.9 Курстың саясаты мен процедурасы оқытушылардың студенттерден міндетті түрде сабаққа қатысуын, барлық бақылау түрі бойынша уақытында есеп беру, сабаққа қатыспаған күндерін қайта тапсыру тәртібін талап етуінен тұрады. Бақылау түрлерін тапсыру барысында оқытылатын пәннің бірізділігін сақтау қажет. Әрбір оқушы бақылау түрлерін бірізділікпен тапсырылуын негіздеуі қажет немесе тәжірибелік сабақтардың берілгендерін, мазмұның топтағы студенттерден көшіріп жазып алуға, ал осы жіберіліп алған (яғни қатыса алмаған) сабақтың тапсырмасы мен түсіндірілуін мұғалімнен индивидуальді түрде жұмыс уақытында алуға рұқсат етіледі. Лабораториялық жұмыстарға кез-келген уақыттта қатыспаған жағдайда оны міндетті түрде 802 БОҒ-да қайта тапсыруы керек.
|
|
|
Студенттің семестр кезіндегі барлық оқу жұмысы балдық-рейтингтік жүйеге негізделген болғандықтан студент барлық жұмыстарды күнтізбелік кесте бойынша тапсыруға және өз уақытында орындауға міндетті (2-3 кестені қараңыз). Бақылау түрлерін тапсыру өз реті бойынша, яғни курсты оқып-үйренуде жоспарлануы және логикалық түрде қойылуы бойынша іске асырылады.
2 НЕГІЗГІ ТАРАТЫЛАТЫН МАТЕРИАЛДАР МАЗМҰНЫ
2.1 «Химияң пәнін оқып-үйрену міндетті дәрістік (1 кредит), тәжірибелік (1 кредит) және лабораториялық (1 кредит) сабақтан тұрады, сонымен бірге студенттің өзіндік жұмысынан (СӨЖ және СОӨЖ) тұрады. Мұндай комплексті сабақтар курсты меңгеруді қамтамсыз етеді және студенттердің фундаментальді химиялық білім алуына көмектеседі.
Пәннің тақырыптық жоспары тақырыптардың атауымен және білімнің барлық түрінің (тақырыптары бойынша) академиялық сағаттарының саны 5 кестеде көрсетілген.
5 кесте
Курстың тақырыптық жоспары
| Тақырыптың атауы | Академиялық сағаттардың саны | ||||
| Дәріс | Тәжірибелік/ семинарлық | Лабораториялық | СОӨЖ | СӨЖ | |
| 1. Кіріспе. Химия пәні. | - | - | |||
| 2. Химияның негізгі түсініктері мен заңдары. | |||||
| 3. Атомдарды құру және химиялық элементтердің систематикасы. | - | ||||
| 4. Химиялық байланыс | - | ||||
| 5. Химиялық реакцияның ағуының негізгі заңдылықтары. | |||||
| 6. Ерітінділер | |||||
| 7. Тотығу-тотықсыздану реакциялары | |||||
| 8. Электрохимияның негізі | |||||
| 9. Комплекс қосылыстар | |||||
| Барлығы (сағат) |
2.2 Дәрістік сабақ конспектілері
І. Дәріс тақырыбы: Кіріспе. Химия пәні (1 сағ.).
Дәріс конспектілері:
|
|
|
Бізді қоршап тұрған және біздің санамыздан тыс өз бетінше өмір сүретін дүние – толып жатқан заттар мен құбылыстар материяға жатады. Материя объективтік шындықты бейнелейтін философиялық категория, материя біздің сезім мүшелерімізге әсер етіп сезім тудырады, бейнеленеді.
Материя негізінен екі формада – зат және өріс түрінде іске асырылады. Материя деген түсінікті затпен біріктіруге, бірлестіруге болмайды.
Зат – белгілі бір массасы бар болатын бөлшектердің (атом, молекула, электрон және т.б.) тұрақты жиыны болып табылады.
Өріс дегеніміз – тұрақты массасы болмайтын кванттардың гравитациялық немесе электромагниттік ағыны.
Затпен өріс теңбе-тең бола алмайды, дегенмен зат бөлшектерінің әрекеттесуі өрісте іске асады.
Материя қозғалыспен тығыз байланысты. Қозғалыс материяның өмір сүру формасы. Химия – материя қозғалысының химиялық формасын зерттейді, нақтырақ айтқанда заттардың түзілуі мен ыдырауын қарастырады.
Сонымен химия дегеніміз – заттардың құрамын, құрылысын, олардың бір түрден екінші түрге айналуын және осы айналу кезінде байқалатын құбылыстарды зерттейтін ғылым.
Химия негізінен элементтерді және олардың қосылыстарын зерттейді. Барлық элементтер (көміртегінен басқасы) мен олардың қосылыстарын зерттейтін химияны бейорганикалық немесе анорганикалық химия дейді. Бейорганикалық немесе анорганикалық қосылыстар 300 мыңнан асады. Тек көміртегі қосылыстарының құрылысын, құрамын, оларға байланысты реакциялар мен құбылыстарды зерттейтін химия органикалық химия деп аталынады. Органикалық қосылыстар 4 миллионнан асады. Бұлардан басқа физикалық химия, электрохимия, химиялық технология және т.б. пәндер оқытылады.
Химияның табиғатты, тірі дүниені зерттеуде және халық шаруашылығын дамытудағы маңызы зор.
|
|
|
Химияның негізгі міндеттеріне халық шаруашылығына қажетті сапалы өнімдер алу, өндіріс қарқынын арттыру, қалдықсыз заттар өндіру және т.б. жатады. Табиғатта халық шаруашылығына қажетті заттар кездесе бермейді. Сондықтан химиялық әдістерді және химияның жетістіктерін пацдаланып алуан түрлі өнімдер өндіріледі.
Қазіргі кезде химиялық синтез әдісін пайдаланып табиғи пайдалы қазбалармен бірге кездесетін қосалқы газдардан органикалық және бейорганикалық химия өнімдерін өндіреді. Әсіресе химия өнеркәсібінде технологиялық процестерді жақсарту және жаңа технологиялық әдістерді іске қосу, өнімдердің шығынын, сапасын арттырумен бірге қоршаған ортаны қорғауға да зор пайдасын тигізіп отыр. Қазіргі кезде химиялық әдістерді пайдаланып өнеркәсіпке қажетті аса таза заттар алу өндірістік мөлшерде жүзеге асырылады.
Халық шаруашылығына қажетті қара және түсті металдарды олардың қосылыстарынан тотықсыздандырып алу тек химиялық реакциялардың негізінде жүреді.
Химиялық реакциялардың негізінде химиялық өнімдер: күкірт қышқылы, азот қышқылы, тұз қышқылы, сілтілер, сода, сабын, резеңкелер, пластмассалар, каучуктер, жасанда талшықтар, мұнай өнімдерін өндіру, сонымен бірге ауыл шаруашылығына қажетті калий, азот, фосфор тыңайтқыштарын және микротыңайтқыштар, гербицидтер т.б. өндіру іске асырылады.
Химиялық реакцияларды пайдаланып, дәрі-дәрмектер, тау-кен жұмысына қажетті қопарғыш заттар өндіреді. Бір ғана мұнайдың өзінен 20 мыңнан астам, ал таскөмірден одан да көп органикалық және минералдық заттар алынады. Химия жетістіктерін пайдаланып қазіргі химия өнеркәсібі 50 мыңнан астам халық тұтынатын өнімдер өндіреді.
Соңғы кезде зор көңіл бөлініп отырған қоршаған ортаны қорғау мәселесінде химияның алатын орны ерекше. Өндірістік суларды (металлургия, химия т.б. өнеркәсіптердің) тазарту ауа және су тазалығын сақтау және бақылау, қалдықсыз жұмыс істейтін өндірісті жүзеге асыруда химия ғылы мен өнеркәсібінің маңызы зор.
Химия ғылымы күрделі даму кезеңдерін өткерді. Химиялық білімдер өндірістің қажеттерін қанағаттандыру мақсатында дамыды. Тіпті біздің жыл санауымыздан бұрын ежелгі Мысыр елінде темір, мыс, күміс, алтын өндірумен, сабын жасау, шыны, спирт өндірумен шұғылданған, маталарды бояуды білген. Сондай-ақ химиялық өндірістер Қытайда, Үндістанда, Месопотамияда жұмыс істеген. Сол кездің өзінде белгілі толып жатқан заттардың әрқайсысының өзіне тән физикалық және химиялық қасиеттерімен жалпы ұқсастық белгілерінің болуы ертедегі ойшылдарды заттардың құрамы туралы пікір айтуға итермеледі. Мысалы, біздің жыл санауымыздан бұрынғы ІV ғасырда өмір сүрген грек философы Демокрит барлық заттар бөлінбейтін – атомдардан тұрады деген пікір айтқан, бірақ бұл пікір тәжірибеге негізделмеген жалпы жорамал еді.
Бірақ материяның атомдардан тұратындығы туралы Демокриттің болжамы көп уақыт ұмыт болып қалды да, оның орнына Аристотельдің (384-332 б.ж.с.д.) элементтер теориясы қабылданы, ол шіркеудің қолдауының арқасында 17 ғасырдай өмір сүрді. Бұл теорияның негізгі мәні жоғары бір күштің әсерінен бір элементті басқа бір элементке айналдыруға болады деп есептеді.
Осы теорияның негізінде әрекет еткен орта ғасырлық химия – алхимия (химияның арабша аты) деп аталды. Алхимия дәуірі шамамен ІV ғасырдан ХVІ ғасырға дейін созылды. Алхимиктердің ғылыми бағыты теріс болды. Олар Аристотельдің теориясына тым сене отырып, жай металдарды алтынға айналдыратын «ғажайып философиялық тастың іздеп әуре болды. Бірақ алхимктердің еңбектері мүлде босқа кеткен жоқ., олардың «философиялық тастың іздеу мақсатында жүргізген тәжірибелерінің нәтижесінде көптеген металдар, қышқылдар, тұздар, дәрі-дәрмектер, бояғыш заттар т.б. алынды.
Алхимиктердің теріс бағытын көптеген ғалымдар ХVІІ-ХVІІІ ғасырларда қатты сынады.
Ғылыми химия М.В.Ломоносовтың (1711-1765ж) еңбектерінен басталады. Ол зат массасының сақталу заңын ашып (1748ж), атом молекулалық ілімінің негізін салды.
Орыстың ұлы ғалымы Д.И.Менделеевтің еңбектерінің химия ғылымын дамытудағы маңызы орасан зор. Ол 1869 жылы аса маңызды табиғат заңы – периодтық заңды ашып, химиялық элементтердің ғылыми жүйесін жасады. Өзінің “Химия негіздері” еңбегінде ол бірінші рет химияны периодтық заң негізінде баяндады. Д.И.Менделеев көп жылдық еңбектерінің нәтижесінде ерітінділердің химиялық теориясын жасады.
Химия ғылымын дамытудағы А.М.Бутлеровтың, Н.Н.Зининнің, А.А.Воскресенскийдің, Е.А.Фаворскийдің, И.С.Курнаковтың, Л.А.Чугаевтің, Г.И.Гесстің және т.б. еңбектері зор болды.
Химия мен химия өнеркәсібінің дамуы халық шаруашылығын химияландыруды үздіксіз арттыруда мүмкіндігі зор.
Химияландыру дегеніміз – халық шаруашылығының барлық салаларында химиялық материалдарды, өнімдерді, химиялық технология әдістерін біртіндеп және қарқынды енгізіп отыру. Химияландыру өндірісті жеделдетуге, еңбек өнімділігін арттыруға және оның тиімділігін көбейтуге жағдай жасайды. Химияландыру экономиканың, мәдениеттің, тұрмыстың өскелең тұтыну мұқтаждығын қанағаттандырып отырады. Кешенді механикаландыру, автоматтандыру, электрлендірумен бірге химияландыру халық шаруашылығындағы ғылыми-техникалық прогрестің маңызды бағытына жатады.
Негізгі әдебиет: [1] – 3-18б; [2] – 4-96б; [3] –10-14б; [4] – 4б; [5] – 5-11б; [6] – 9-16б.
Қосымша әдебиет: [6] – 9-12б
Бақылау сұрақтары:
1. Материяның қандай формасы зат деп аталады?
2. Материя қозғалысындағы химиялық форма нені білдіреді?
3. Химия пәні нені зерттейді?
4. Бейорганикалық химия нені зерттейді?
5. Химияның техника мен технологиядағы мәні.
ІІ. Дәріс тақырыбы: Химияның негізгі түсініктері мен заңдары (2сағ.).
Дәріс конспектілері:
1. Атом-молекулалық теориясы: 1748 жылы М.В.Ломоносов ашқан атом-молекулалық ілім химияның ғылыми негізі болып табылады.
1) барлық заттар элементтерден (атомдар) және корпускуладан (молекула) тұрады.
2) бұл бөлшектер үздіксіз қозғалыста болады, яғни жылудың табиғи әсерімен түсіндіріледі.
2. Масса және салмақ түсінігі.
Масса – дененің немесе заттың қасиеті. Масса – гравитациялық өріс көрсету қабылетімен сипатталады да, m – деп белгіленеді. Өлшем бірлігі СИ-жүйесінде – кг, г.
Салмақ – дененің гравитациялық өріспен әрекеттесуі нәтижсінде пайда болатын күш және салмақ еркін түсу үдеуінде (g)-ға тәуелді: h=m*g.
Заттың массасы арнайы таразыларда (иінді, пружиналы) өлшенеді, дене салмағы – динамометрмен өлшенеді. Химияда көбінесе масса түсінігі жиі қолданылады.
3. Салыстырмалы атомдық және молекулалық масса. Массаның атомдық бірлігі.
Атомдар мен молекулалардың абсолютті массасы өте аз шама:
mа(Н)=1,674*10-24г,
mа(С)=1,993*10-23г,
mм(Н2О)=2,99*10-23г.
Мұндай шамалармен есептеулер өте күрделі, ыңғайсыз. 1961 жылдан бастап а.м.б. ретінде көміртегі 12 изотобының атомы массасының 1/12 бөлігі алынған. 1,66-10-24 г тең. Осыдан, мысалы
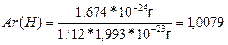 |
 |
Ar(H) – дегеніміз сутегі атомының салыстырмалы массасы, бұл шама сутегі атомы а.м.б. неше сес ауыр екенін көрсететін, өлшем бірліксіз шама. Mr(H2O) – судың салыстырмалы молекулалық массасы.
Судың салыстырмалы молекулалық массасын – сутегінің және оттегінің салыстырмалы атомдық массаларының қосындысымен есептеуге де болады:
Mr(H2O)=2*1.0079+15.999=18.015
4. Моль. Молярлық масса. Авагадро тұрақтысы.
СИ – жүйесінде моль – зат мөлшерінің өлшем белгіленуі ν(Са)=1,2 моль, ν(NаOH)=3 моль.
Моль дегеніміз – көміртегі С-изотобында 12г қанша атом болса, сонша құрылымдық бөлшектер (молекула, атом, иондар) болатын заттың мөлшері болып табылады. 12г-да 6,02*1023 құрылымдық бөлшектер болатыны анықталған.
Авагадро тұрақтысы деген осы шама:
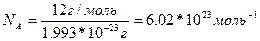
Молярлық масса заттың молінің массасы, өлшем бірлігі г/моль. M(NaOH)=40 г/моль. Молярлық массасы сандық және салыстырмалы молекулалық массаға тең болады:
M=Mr.
Заттың мөлшерімен молярлық массасы массамен төмендегідей қатынаста болады:
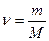 немесе m=n*M
немесе m=n*M
Заттың молекулалық массасын жеке молекула массасымен Авагадро тұрақтысы арқылы есептеуге болады.
M(H2O)=2.99*10-23г*6,02*1023моль-1=18г/моль
Жеке атомның немесе молекуланың массасының сандық мәнің м.а.б. немесе Авагадро тұрақтысын қолдана отырып табуға болады:
Ma(Fe)=1.66*10-24г*56=9.29*10-23г немесе

5. Химияның негізгі заңдары.
Массаның және энергияның сақталу заңын 1748 жылы М.В.Ломоносов тұжырымдаған: Химиялық реакцияға қатысушы заттардың массасы өзгермейді. 1905 жылы Эйнштейн энергиямен массаның өзара байланысын, тәуелділігін көрсеткен.
E=m*c2
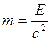
c=3*108м/с
Масса мен энергия материяның бөлінбес қасиеті. Масса энергия өлшемі, ал энергия – материя қозғалысының өлшемі. Сол себептен олар өзара эквивалент (тең) емес, бір-біріне ауыспайды, дегенмен дене энергиясы өзгергенде (Е), оның массасы да өзгереді. Массаның шамалы өзгерісі ядролық химияда жиі байқалады.
Атом молекулалық теория тұрғысынан қарағанда тұрақты массаға ие атомдар жойылмайды, жоқтан пайда болмайды. Бұл тұжырым зат массасының сақталуын көрсетеді және тәжірибе жүзінде дәлелденген. Осы заңға сүйене отырып химиялық теңдеулер құрылады. Реакция теңдеулері арқылы жасалатын сандық есептеулер – стехиометриялық есептеулер деп аталады. Барлық сандық есптеулер негізінде зат массасының сақталу заңы жатады, сонымен өндірісті жоспарлауға, бақылауға болады.
6. Құрам тұрақтылық заңын 1808 жылдары француз ғалымы Пруст тұжырымдаған: кез-келген таза заттың алыну жолдарына қарамастан, сапалық және сандық құрамы тұрақты болады, егер берілген агрегаттық күйде молекулалық құрылымдары болса. Судың құрамында массасы бойынша 11.19% сутегі, 88.81% оттегі болады, бұл сандық құрамы, ал сутегі (Н) мен оттегі (О) элементтері – сапалық құрамын көрсетеді.
Дальтонидтер - бүтін санды коэффициентті, құрамы тұрақты сандар: H2O, CH4, HCl, C6H6.
Бертолидтер – бөлшекті индексті, құрамы айнымалы, тұрақсыз заттар TіO0.7-TіO1.3. Бұларға оксидтер, гидридтер, сульфидтер және т.б. жатады.
7. Еселік қатынас заңын 1803 жылдары ағылшын ғалымы Дальтон ашқан, газ-бу күйіндіге, қосылыстарға тән заңдылық. Дальтонидтердің құрамы секірмелі түрде өзгереді, яғни реакцияға бүтін санды атомдар қатысады, сандық құрылым сапалық құрамға ауысады. Ф.Энгельстің сараптауынша бұл табиғаттың, қоғамның және таным дамуының бүкіл әлемдік заңы, яғни химия сандық құрамы өзгеруі әсерінен болатын дененің сапалық өзгерісі жөніндегі ғылым.
8. Эквиваленттер заңын 1791 жылы Рихтер ашқан. Элемент атомдары бірімен-бірі нақты алынған эквиваленттік қатынаста әрекеттеседі.
СИ жүйесінде эквивалент нақты бөлшектің (Х) 1/z бөлігі. Х – алынған атом, молекула, ион және т.б. Ал z нақты бөлшек байланысатын немесе беретін протон санына тең (нейтралдану эквиваленті), тотығу-тотықсыздану эквиваленті болғанда (Х) бөлшек беретін немесе қосып алатын электрон санына тең. Иондық эквивалент болғанда (z) ион зарядының шамасына тең.
 - эквиваленттің молярлық массасы, өлшемі – г/моль. Бұл шама (Х) бөлшектің молярлық массасының (z) санының қатынасына тең.
- эквиваленттің молярлық массасы, өлшемі – г/моль. Бұл шама (Х) бөлшектің молярлық массасының (z) санының қатынасына тең.
Мысалы: элементтің молырлық массасының оның валенттілігіне қатынасымен анықталынады. Су молекуласында
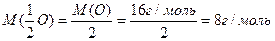

Al2O3 молекуласында 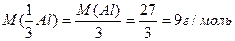
Эквиваленттер заңы:
Әрекеттесуші заттар массаларының қатынасы олардың эквиваленттерінің молярлық массасының қатынасындай болады.
Математикалық өрнегі:

мұндағы m1 және m2 - әрекеттесуші заттар массасы,
 және
және  – олардың эквиваленттерінің молярлық массасы.
– олардың эквиваленттерінің молярлық массасы.
Егер әрекеттесуші заттардың мөлшері массамен емес, көлеммен сипатталса (V(x)), онда эквивалент өрнегіндегі молярлық масса (Э) эквиваленттің молярлық ммассасының өрнегімен ауыстырылады.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2142; Нарушение авторских прав?; Мы поможем в написании вашей работы!