
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Моноаміни
|
|
|
|
Аміни аліфатичного ряду
Амінами називаються похідні аміаку, у яких один, два або всі три атоми гідрогену заміщені вуглецевими радикалами.
У залежності від кількості заміщених атомів гідрогену вуглецевими радикалами розрізняють первинні, вторинні й третинні аміни:
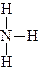
| 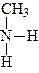
| 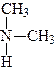
| 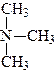
|
| аміак | первинний амін | вторинний амін | третинний амін |
Номенклатура і ізомерія. За раціональною номенклатурою аміни дістають назви від радикалів, зв’язаних з атомом азоту, з додаванням закінчення -амін, наприклад:
CH3–NH–C2H5 – метилетиламін; (СН3)2–СН–NН ізопропіламін.
За женевською номенклатурою перед назвою вуглеводню ставиться приставка аміно- з цифрою, яка показує положення групи, наприклад:
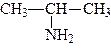
| 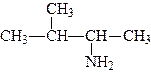
|
| 2-амінопропан | 3-аміно-2-метилбутан |
Ізомерія амінів залежить від: 1) ізомерії радикалів, 2) місцеположення аміногрупи, 3) наявності у молекулі аміну кількох різних радикалів (метамерія). Так, диметиламін (CH3)2NH метамерний (ізомерний) етиламіну СН3СН2NН2.
Способи добування. 1. Добування з галогенопохідних вуглеводнів і аміаку (реакція Гофмана). Аміак, приєднуючи молекулу галогеноводню, утворює амонійну сіль галогеноводневої кислоти:
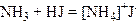 .
.
Подібно до цього при взаємодії аміаку з галогеналкілом утворюється сіль первинного аміну:
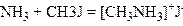
З надлишком аміаку частково утворюється і вільний первинний амін:
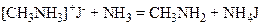
який, приєднуючи молекулу галогеналкілу, утворює сіль вторинного аміну:
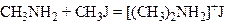 .
.
При дальшій дії аміаку утворюється вторинний амін:
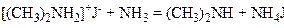 .
.
Аналогічно утворюється третинний амін:
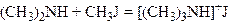 ,
,
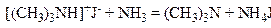 .
.
До одержаного третинного аміну може приєднатися нова молекула галогеналкілу, утворюючи сіль чотиризаміщеного амонію, яка вже не розкладається аміаком. Як бачимо, при дії аміаку на галогеналкіли утворюється суміш солей всіх чотирьох амонієвих основ. Одержану суміш піддають розкладу. Таким чином, користуючись цим способом, можна добувати первинні, вторинні й третинні аміни.
|
|
|
2. Добування з амідів кислот. Первинні аміни, як установив у 1881 p. Гофман, можна добувати нагріванням амідів кислот з лужними розчинами хлорноватистих або бромноватистих солей:
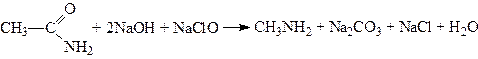 .
.
3. Відновлення нітросполук (реакція Зініна). При відновленні нітросполук нітрогрупа – NO2 перетворюється на аміногрупу – NH2, при цьому утворюються первинні аміни. Як відновники найчастіше застосовуються метали: олово, цинк або залізо у присутності хлоридної кислоти (див. вище).
4. Відновлення нітрилів. Первинні аміни можна добувати відновленням нітрилів:
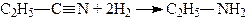 .
.
5. Взаємодія спиртів з аміаком. Сучасний промисловий метод добування первинних, вторинних і третинних амінів аліфатичного ряду полягає у взаємодії спиртів з аміаком над оксидом алюмінію або торію при температурі близько 300°С:
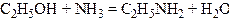 ,
,
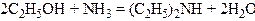 ,
,
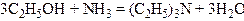 .
.
6. Добування первинних амінів. Найбільш зручний метод добування чистих первинних амінів зводиться до алкілування фталіміду калію з наступним омиленням продукту реакції (реакція Габріеля):
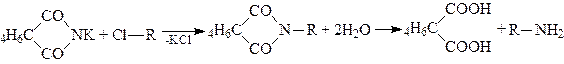 .
.
Фізичні властивості. Перші представники гомогологічного ряду амінів: метиламін, диметиламін і триметиламін – горючі гази, середні члени ряду – рідини, вищі – тверді, нерозчинні у воді речовини. Нижчі гомологи добре розчиняються у воді. Зі збільшенням молекулярної маси розчинність зменшується і підвищується температура кипіння амінів. Нижчі гомологи мають сильний запах, який нагадує запах аміаку, вищі – не мають запаху.
Хімічні властивості. 1. Основні властивості. Як органічні похідні аміаку аміни мають основні властивості. При цьому аміни жирного ряду у водних розчинах є більш сильними основами, ніж аміак.
Основність амінів пояснюється здатністю атома нітрогену з неподіленої електронної пари до приєднання протона з утворенням іона заміщеного амонію. Гідроксиди амінів нестійкі, як і гідроксид амонію, і при нагріванні повністю розпадаються з утворенням вільного аміну.
|
|
|
2. Утворення солей. Усі аміни аліфатичного ряду подібно до аміаку вступають у реакцію приєднання з кислотами, утворюючи солі типу солей амонію. Солі амінів – тверді речовини без запаху, в більшості добре розчинні у воді. При дії лугів солі амінів подібно до солей амонію розкладаються з виділенням вільного аміну.
3. Реакція з галогеналкілами. Третинні аміни при дії на них галогеналкілів утворюють солі, які за своєю будовою нагадують хлористий амоній:
(СН3)3N + CH3Cl = [(CH3)2–N+–(CH3)2]Cl-.
4. Ацилювання. Первинні й вторинні аміни взаємодіють з карбоновими кислотами, ангідридами кислот і галогенангідридами органічних кислот, утворюючи ацильні похідні амінів, наприклад:
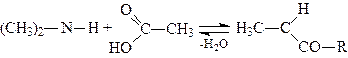 ,
,
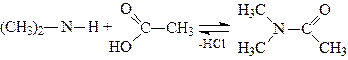 .
.
Третинні аміни в реакцію ацилювання не вступають.
5. Реакція з азотистою кислотою дає можливість розрізняти І, ІІ й ІІІ аміни.
а) При дії азотистої кислоти на первинні аміни відбувається виділення вільного азоту й утворення спиртів:
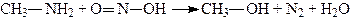 .
.
б) Вторинні аміни, реагуючи з азотистою кислотою, виділяють воду і утворюють нітрозаміни – нейтральні речовини, які погано розчиняються у воді:
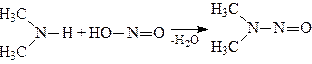 .
.
При дії концентрованих мінеральних кислот нітрозаміни знову дають утворюють вихідних амінів.
в) Третинні аміни з азотистою кислотою не реагують.
6. Утворення ізонітрилів. При нагріванні первинного аміну з хлороформом і спиртовим розчином лугу утворюється ізонітрил:
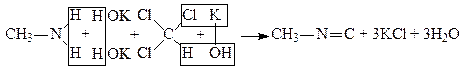 .
.
Ізонітрили мають огидний запах, і це використовують для відкриття первинних амінів.
Окремі представники. Метиламін CH3NH2 утворюється при розкладанні білків, деяких алкалоїдів. У промисловості його добувають нагріванням суміші формаліну з хлористим амонієм. Метиламін являє собою горючий газ з різким нудотним запахом. Застосовується при виготовленні фармацевтичних препаратів, алкалоїдів груп тропану й барвників антрахінонового ряду.
Диметиламін (CH3)2NH міститься разом з триметиламіном в оселедцевому розсолі та в тухлих оселедцях.
Найбільш простий спосіб добування диметиламіну (в суміші з метил і триметиламіном) полягає у взаємодії метилового спирту з аміаком під тиском у газовій фазі над каталізатором типу глинозему.
|
|
|
Диметиламін являє собою газ з різким неприємним запахом, легко скраплюється при охолодженні або під тиском у безбарвну рідину. Застосовується для добування тетраметилтіурамідсульфіду – прискорювача процесу вулканізації каучуку, а також використовується при добуванні дуже ефективної лікарської речовини – аміназину.
Триметиламін (CH3)3N міститься в оселедцевому розсолі, тухлих оселедцях і квітах деяких рослин, надаючи їм неприємного запаху. Триметиламін являє собою газоподібну речовину. В концентрованому стані має запах, дуже схожий на запах аміаку, а в невеликих концентраціях запах гнилої риби і ворвані.
Діетиламін (C2H5)2NH – безбарвна рідина з різким запахом. У промисловості добувають при взаємодії етилового спирту з аміаком при 300 – 450°С і лід тиском 15–30 ат. Застосовується діетиламін як проміжний продукт у виробництві багатьох лікарських речовин, наприклад кардіаміну, новокаїну та ін., а також для добування дисульфідтетраетилураму – прискорювача вулканізації каучуку.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1482; Нарушение авторских прав?; Мы поможем в написании вашей работы!