
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1
Ток, проходя через раствор кислоты выделяет за 3 мин 50 см3 водорода, измеренных при 17°С под давлением 99300 Па. Рассчитать силу тока.
| I -? | Cu | 1) Силу тока рассчитывают по объёдинённому закону Фарадея m = Э×I t/F; I = m×F/Э t
Э(Н) = 1
2) Сначала необходимо найти массу вещества из уравнения состояния идеального газа
PV = mRT/М; m= PVM/RT
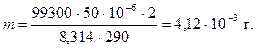
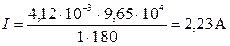 . .
|
| t = 3 мин V = 50 см3 t = 17°C P = 99300 Па R = 8,314 Дж/(моль×К) F = 9,65×104 Кл/экв М(Н2) = 2 г/моль | 180 с 50×10-6 м3 290 К |
Пример 2
При рафинировании меди ток 50А выделяет за 4 часа 224 г меди. Рассчитать выход по току.
| h -? | Cu | 1) По закону Фарадея рассчитаем m = Э×It/F = 32×50×14400/9,65×104 = 237 г. Э (Сu) = M /п = 64/2 = 32 2) h = mпр×100%/mтеор; h = 224×100%/237 = 94,45% |
| t = 4 ч mпр = 224 г I = 50А F = 9,65× 104 Кл/моль | 14400 с |
Пример 3
Вычислить ЭДС гальванического элемента при 25°С.
Ag/AgNO3//NiSO4/Ni
Концентрация раствора AgNO3 m1 = 0,005 моль/1000 г Н2О, раствора NiSO4 m2 = 0,1 моль/1000 г Н2О. Коэффициент активности для AgNO3 = 0,925, для NiSO4 = 0,15.
| Е -? | 1) ЭДС рассчитываем по формуле Е = j2 - j1 2) Рассчитываем по формулам Нернста потенциалы j j 2Ag/Ag+ = j° + R×T×lna×(Ag+)/n×F a (Ag+) =γ×m j 0Ag°/Ag + = 0,799 В (табличное значение – приложение № 4) |
| m(AgNO3) = 0,005 моль/кг m(NiSO4) = 0,1 моль/кг γ(AgNO3) = 0,925 γ(NiSO4) = 0,15 |
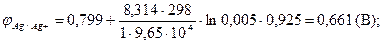
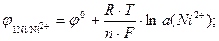
a (Ni2+) = γ ×m
j°Ni/Ni2+ = - 0,23 В (табличное значение)

Е = j2 - j1 = 0,661 – (–0,284) = 0,945 В.
Вопросы для самоконтроля
1) Прикладное значение электрохимии.
2) Гальванический элемент Якоби – Даниэля, возникновение электрического тока.
3) Концентрационные элементы. Диффузионный потенциал.
4) Электроды сравнения: нормальный водородный электрод, каломельный, хлорсеребряный.
Раздел 2. Основы коллоидной химии.
Тема 2.1. Дисперсные системы.
Коллоидная химия – наука о свойствах гетерогенных высокодисперсных систем (т.е. систем находящихся в мелкораздробленном состоянии) и о процессах протекающих в этих системах.
Коллоидные системы состоят: из – дисперсной фазы – совокупность твёрдых частиц или пор находящихся в высокодисперсном состоянии и распределённых в какой-либо соответствующей среде – дисперсионной среде.
Теория, которая изучает строение коллоидной частицы, называется мицеллярной теорией.
Коллоидный раствор состоит из:
1) мицеллы
2) интермицеллярной жидкости
Мицелла – электрически нейтральная структурная коллоидная единица окружённая двойным электрическим слоем.
Мицелла состоит из:
1) агрегата (или зародыша), который образуется из нейтральных молекул или атомов.
2) Адсорбционный слой, который состоит из ионов и противоинов стабилизатора.
Стабилизатор – это то вещество, которое берётся в избытке, для того чтобы образовался коллоидный раствор и не выпал осадок вещества.
Ионы, которые адсорбируются на агрегате и придают ему определённый заряд называют потенциалобразующие (ионы, которые имеются и в агрегате, и в стабилизаторе)
Агрегат + потенциалобразующие ионы – это ядро.
3) Диффузный слой. Он состоит из оставшихся ионов стабилизатора.
Например:
КI+Ag NO3 → Ag I ¯ + K N O3.
в обычных условиях образуется осадок йодида серебра, но если взять избыток какого-либо вещества, то образуется коллоидный раствор.
1) В качестве стабилизатора (избытка) берём Ag N O3


 [ m Ag I] n Ag+ (n - x) N O3 – x+ × x N O3 –
[ m Ag I] n Ag+ (n - x) N O3 – x+ × x N O3 –
агрегат потенциал противо
образующие ионы
 ионы стабилизат.
ионы стабилизат.
 |
ядро диффузионный
 слой
слой
адсорбционный
слой
 |
частица или гранула
 |
мицелла
Тема 2.2. Растворы высокомолекулярных соединений (В.С.М.)
В.С.М. – полимеры, соединения, молекулы которых содержат тысячи и десятки тысяч атомов, масса моля составляет сотни тысяч единиц.
Вопросы для самоконтроля по разделу 2. Коллоидная химия.
- Привести пример коллоидных систем, грубодисперсных систем, ВМС.
- Сравнить свойства истинных растворов, коллоидно-дисперсных систем, грубодисперсных систем.
- Дать определение следующим понятиям: броуновское движение, седиментация, эффект Фарадея – Тиндаля, электроосмос, электрофорез, коллоидная устойчивость, коагуляция, коллоидная частица, высаливание, набухание.
|
|
Дата добавления: 2014-11-18; Просмотров: 1094; Нарушение авторских прав?; Мы поможем в написании вашей работы!