
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обмеження. 2 страница
|
|
|
|
реактора,слід проiнтегрувати (2.36).
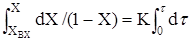
Отримаємо:
-ln(1–X)=Kt (2.37)
Перетворив (2.37),одержимо:
 X = 1 – e–Kt (2.38)
X = 1 – e–Kt (2.38)
Одержаний вираз дозволяє визначити Х по довжині реактора (рiс.2.12).
З аналізу(2.38) видно,що практично неможливо одержати ступінь перетворення рівну 1
Аналогічна залежність-зміна концентрації по довжині реактора має вигляд:
Рис 2.12 С = С0 – e–Kt (2.39)
2.Зміна ступеня перетворення при адiабатичному режимі
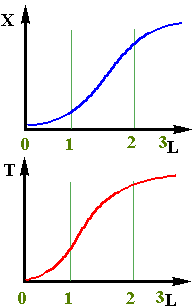 При адiабатичному протіканнi процесу визначити зміну ступеня перетворення по довжині реактора можна тільки при сумісному рішенні дорівнень матеріального і теп-лового балансів. Якісно цю залежність можна пояснити наступним чином (рiс.2.13). На початковій дільниці шару (0- 1) ступінь перетворення буде мала, тому що із-за низьких температур швидкість хiмiчного перетворення буде невелика. На наступних дільницях шару за рахунок протікання хімічної реакції температура зростає, концен-трація вихідного компонента ще достатньо велика і швидкість реакції помітно збільшується,що приводить до чималого збільшення ступеня перетворення (участок 1 - 2). До кінця шару (участок 2 - 3) вихідного компоненту практично не залишається і,відповідно, швидкість реакції
При адiабатичному протіканнi процесу визначити зміну ступеня перетворення по довжині реактора можна тільки при сумісному рішенні дорівнень матеріального і теп-лового балансів. Якісно цю залежність можна пояснити наступним чином (рiс.2.13). На початковій дільниці шару (0- 1) ступінь перетворення буде мала, тому що із-за низьких температур швидкість хiмiчного перетворення буде невелика. На наступних дільницях шару за рахунок протікання хімічної реакції температура зростає, концен-трація вихідного компонента ще достатньо велика і швидкість реакції помітно збільшується,що приводить до чималого збільшення ступеня перетворення (участок 1 - 2). До кінця шару (участок 2 - 3) вихідного компоненту практично не залишається і,відповідно, швидкість реакції
зменьшується і ступінь перетворення практично не Рис 2.13 змінюється
2. 2. 3. Зіставлення РІЗ та РІВ
Порівняння реакторів найбільш слушно проводити по якомусь параметру, що визначає техніко-економічні показники. У вигляді такого параметра частіше всього використовують час перебування t. Співвідношення між часами перебування в РІЗ (tз) і в РІВ (tв) залежно від ступеня перетворення розглянемо для простійшого випадку - протікання реакції першого порядку при iзотермічних умовах і постійному обсязі.
|
|
|
Для РІЗ із (2.7) слідує:
t = (CBX – C)/W (2.40)
де t = V / Q.
Так.як.у данному випадку W=K×C, то висловивши в (2.40) значення концентрації через ступінь перетворення,отримаємо залежність часу
перебування від ступені перетворення для РІЗ:
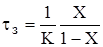 (2.41)
(2.41)
Для РІВ залежність часу перебування від ступені перетворення може бути одержана з рівняння (2.37)
tв= – 1 / K – Ln(1–X) (2.42)
Тоді відношення t = –1/K–Ln(1–X) буде функцією тільки ступені перетворення:
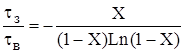 (2,43)
(2,43)
Проведемо зіставлення РІЗ і РІВ,задаючи різні значення міри ступе ні перетворення, зіставляючи моделі по відношенню tC/tB (табл.2.2)
Таблиця 2.2
| X | 0.5 | 0.7 | 0.8 | 0.9 | 0.99 | |
| tC/tB | 1.5 | 2.0 | 2.5 |
З приведеного зіставлення видно,що час перебування у реакторі ідеального змішеняя завжди більше,ніж у реакторі ідеального витиснення. При цьому, чим вище ступінь перетворення Х, тим t більше відрізняється від tB.
Оскільки час перебування прямопропорційний обсягу апарата, то необхідний обсяг РІЗ завжди більше,чим обсяг РІВ. При рівних обсягах реакторів ступінь перетворення Х в РІВ досягає понад більш високих значень,чим у РІЗ. Треба визначити,що відношення обсягу реакторів збільшується з підвищенням порядку реакції.
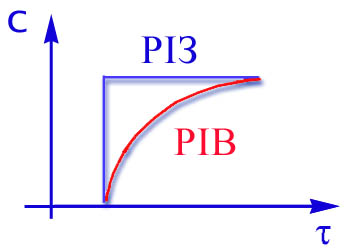
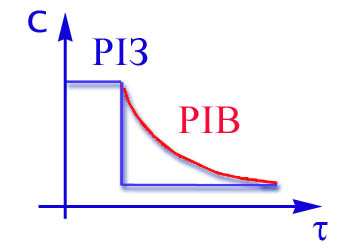
Графіки залежності ступеня перетворення і концентрації від часу контакту приведені на рис.2.14 та 2.15.
| 
|
Рис 2.14 Рис 2.15
Для РІВ ступінь перетворення та концентрація змінюється плавно по всій довжині реактора,тому у будь-якому перетині по t середня швидкість процесу вище,чим у РІЗ.
Незважаючи на очевидні привілеї РІВ в хімічній промисловiсті надто часто застосовуються і РІЗ, особливо у вигляді каскада реакторів. Це пояснюється передусім простотою їх виготовлення, полегкістю регулювання температури, доступністю узлів апарату, що полегшує очистку внутрішніх поверхностей.
2. 3. 5. Ячеєчна модель
Ця модель схематично представляє реальний апарат як деяке число однакових послідовно сполучених ячеєк (аппаратів) ідеального змешення (рiс.2.17) Сумарний обсяг всіх ячеєк дорівнює обсягу реального апарату, отже, обсяг кожної ячейкi дорівнює V/n. Кількість ячеєк n є параметром, що характеризує ячеєчну модель реального апарату. Якщо n = 1, оте ячеєчна модель переходить у модель ідеального
|
|
|
перемішення, а у випадку n = ∞ – у модель ідеального витіснення.
У ряді випадків в апаратах справді можна виділити дільниці по ходу потоку, в кожному з яких режим близок до ідеального перемішення - каскад реакторів ідеального перемішення, тарельчата барботажна колона, реактор з кiпящим шаром.

Рис 2.17
При складанні ячеєчної моделі використовуються наступні допущення:
- в кожній ячейкі потік має структуру ідеального перемішення й концентрація Cі не змінюється у межах відповідної ячейкi (i=1,2, n - індекс ячейкi);
- перемішення між ячейками відсутнє;
- об'ємна швидкість Q не змінюється.
Крім отого,частіше всього для вигоди розрахунків приймається, що
- объєм кожної з n ячєєк однаков та дорівнює Vi:
- сума объємів всіх ячеєк дорівнює загальному обйому зони,для якої справедлива ячеєчна модель (V = nVi)
- середній час перебування часток у кожній ячейкі t=V/Q=tс/n, а середній час перебування у системі tс = V/Q.
Оскільки у кожної ячейкі дотримується режим ідеального перемішення, оте для будь-який i-ой ячейкi справедливо порівняння моделі РІС:
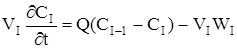 (2.43)
(2.43)
або
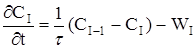 (2.44)
(2.44)
де i = 1, 2,...,n.
Система порівняннь уявляє собою матеріальні баланси в кожної з прийнятих n ячеєк.
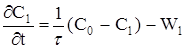
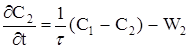 (2.45)
(2.45)
………………..
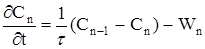
Рівняння енергетичного балансу має наступний вигляд:.
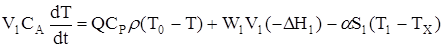
…………………………………………. (2.46)
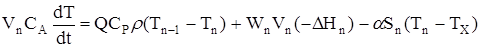
Кiнетичні порівняння
Оскільки концентрація змінюється східчасто від ячейкi до ячейкі, оте швидкості реакції в кожному реакторі різні.
W = F(CI,ТI), I = 1, 2, 3... n
Початкові умови та обмеження записуються для кожної ячейкi аналогічно моделі РIС.
Порівняємо профілі концентрацій у реакторах РІВ, РІЗ та каскаді реакторів ідеального перемішення при n=3 (рiс. 2.18). Зіставлення проводиться при однакових початкових концентраціях САо і Х = const, де Х - міра перетворення.
 Для останньої ячейкi концентрація речовини А у ячеєчної моделі співпадає з його концентрацією при ідеальних режимах (витиснення та перемішення).Но перші ячейкi працюють при великих значеннях СA,чим ячeєчна модель при режимі ідеального витиснення, та, відповідно,в них швидкість хімічного перетворення вище. Інакше кажучи, середня концентрація у каскаді реактора виявляється більш
Для останньої ячейкi концентрація речовини А у ячеєчної моделі співпадає з його концентрацією при ідеальних режимах (витиснення та перемішення).Но перші ячейкi працюють при великих значеннях СA,чим ячeєчна модель при режимі ідеального витиснення, та, відповідно,в них швидкість хімічного перетворення вище. Інакше кажучи, середня концентрація у каскаді реактора виявляється більш
|
|
|
Рис.2.18 високою, чим у РИС. Тому обсяг каскаду реакторів завжди менш, ніж обсяг одного РИС при отих же характеристиках процесу.
Для необернутої реакції першого порядку міра перетворення при будь-якому числі ячеєк n визначається по наступній формулі:
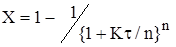 (2.47)
(2.47)
Легко переконатися,щo при n = 1 вираз (2.47) переходить у (2.13), а при n → ∞ прагне до (2.38). Також з (2.47)видно,що з зростанням числа ячеєк міра перетворення достатньо швидко наближається до результатів,характерних для режиму ідеального витіснення.
Цим і пояснюється, що у хімічній технології часто використовують прийом секціонiрованiя - апарати, у яких створюється інтенсивне змішення потоку, поділяють на послідовні секції.
2. 4. Дифузійна модель з подовжнім переносом речовини та тепла
Далеко не завжди вдається описати процес,який протікає у промисловому реакторі, ідеальними моделями.Так,наприклад, для порівняно невеликих по довжині реакторів при малих лiнейних швидкістях потоку реакційної суміші для опису адiабатичного режиму протікання процесу не підходить ані РІЗ, ані РІВ. Очевидно, що ми маємо справу з деякою проміжною нагодою, де має місце неповне змішення по потоку, т.є. на режим ідеального витиснення накладається часткове перемішення. Це підтверджується iмпульснимi та разгонними характеристика ми дифузійної моделі,що показують реакцію об'єкту при нанесенні на вході iмпульсного або стрибкообразного обурення (рiс.2.19, 2.20)
 Рис 2.19. Iмпульсні характеристики
Рис 2.19. Iмпульсні характеристики
(τ- час перебування суміші у реакторі).
Спершу розглянемо одномірний випадок – перенос речовини здійснюється тільки у продольному напрямку. Така модель отримала назву однопараметрична дифузійна модель (рiс.2.21). Висновок рівнянь балансів здійснюється аналогічно РІВ.
Рис 2.20. Разгонні характеристики
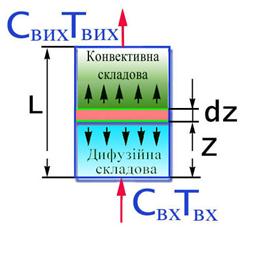
Характер процесів переносу визначається двома складовими:
|
|
|
1.конвективной – яка відповідна режиму ідеального витиснення;
2.дифузійної – яка описує гуртовий вплив різноманітних факторів,що виражаються у відході одніх часток потоку вперед і відставанні інших
Для опису другої складової використовуємо закон Фіка:
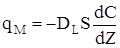 (2.48) Рис.2.21
(2.48) Рис.2.21
де qм - кількість речовини, що дифундує у прямому та зворотному напрямку;
DL - ефективний коефіціент продольной дiффузii;
dc/dz- градієнт концентрації;
S - площа поперечного перетину.
Знак " - " у порівнянні (2.48) показує,що дифузійний потік завжди скерований вбік зменшення концентрації.
Складемо математичну модель дифузійної моделі.
Матеріальний баланс:
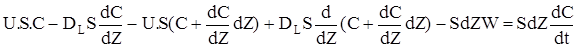 (2.49)
(2.49)
У порівняннi (2.49) перші два доданка враховують перенос речовини через нижній кордон виділеного елементарного обсягу: перше - прихід за рахунок конвективного потоку, друге - унос за рахунок дифузійного потоку.Третій та четвертий доданок - перенос речовини через верхній кордон:третє - унос з конвективним потоком, четверте - прихід за рахунок дифузійного потоку. П'ятий доданок враховує зміну кількості речовини за рахунок хімічної реакції.
В правої частині - зміна кількості речовини у виділеному елементарному обсязі в часу. Після скорочення і ділення на SdZ одержимо:
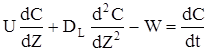 (2.50)
(2.50)
Порівняння (2.50) становить матеріальний баланс однопараметричної дифузійної моделі.Перший доданок враховує перенос речовини за рахунок конвективного потоку,другий - за рахунок дифузійного потоку, третій-за рахунок хімічної реакції.
Pівняння енергогетичного балансу складається аналогічно, а замість закона Фіка використовується закон Фур'є:
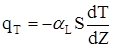 (2.51)
(2.51)
де qТ - кількість теплоти,яка переноситься за рахунок теплопроводтностi;
aL - ефективний коефіціент продольної теплопроводностi;
dT/dz- градієнт температур.
Знак " - " у (2.51) означає,що передача тепла здійснюється у сторону зменшення температури.
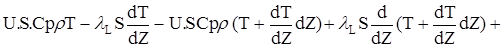
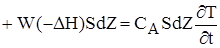 (2.52)
(2.52)
Перетворив (2.52),одержимо порівняння енергетичного балансу:
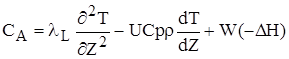 (2.53)
(2.53)
Порівняння кiнетики й початкові умови аналогічні моделі РIВ:
W = f(Т,С) (2.54)
Т = ТПОЧ (Z) С = CПОЧ (Z) (2.55)
Краєві (кордонні) умови необхідно задавати як на вході, так і на виході із реактора. Для висновку цих умов у загальному віпадку необхідно скласти матеріальний та тепловий баланси для вхідного та вихідного перетина реактора. На відміну від балансів, які виводяться для елементарного обсягу, в даному випадку не враховуються зміни за рахунок хімічної реакції та накопичування, тому що товщина шару dZ=0 та отже, доданкі, що містять dZ, також дорівнюють 0.
Спочатку розглянемо перетин Z=0:
 (2.56)
(2.56)
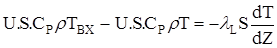 (2.57)
(2.57)
Після перетворень одержимо кордонні умови у наступному виді:
Z = 0: 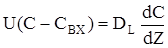
 (2.58)
(2.58)
При Z=L, т.є. на виході з реактора, як правило,швидкість хімічного перетворення вкрай мала,оскільки процес виходить або на повну, або на рівноважну міру перетворення.Отже, градієнти температур та концентрацій відсутні. Тому можна записати:
Z = L: dС/dZ=0; dТ/dZ=0; (2.59)
2.5. Двохпараметрична дифузійна модель
На відміну від попередньої моделі,що враховує зміну концентрацій та температури тільки у продольному напрямі, двохпараметрична модель враховує зміну цих параметрів ще й у радiальному напрямі. Надана модель використовується,в основному,для опису процесів у трубчатих реакторах.
За рахунок чого виникає радiальний перенос? При проходжннi хімічної реакції в трубчатом реакторі у його міжтрубном просторі циркулює теплоноситель, що відводить або підводить тепло.Температура теплоносителя Тх відрізняється від температури всередині трубки Т, що приводить до виникнення градієнту температур по діаметру трубки. Це, у свою чергу, буде причиною виникнення градієнту концентраций.
Для опису радiального переносу використовуються Dг, гl - ефективні коефіцієнти дифузії та теплопроводностi у радiальному напрямку.Інші позначення аналогічні попередньої моделі.
Порівняння матеріального балансу має вид:
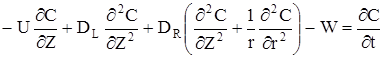 (2.60)
(2.60)
Перші три доданка цілком аналогічні однопараметричної дифу зійної моделі. Четвертий доданок враховує перенос речовини за рахунок радiальної дифузії.В останньому доданку 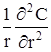 облічуємо зміну площі поперечного перетину по мірі
облічуємо зміну площі поперечного перетину по мірі
віддаління від центру трубки Порівняння енергетичного балансу має вигляд:
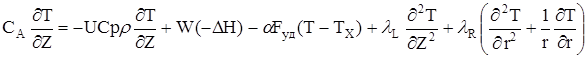 (2.61)
(2.61)
Кiнетичне порівняння та початкові умови такі ж,як і в попередній моделі:
W=f(C,Т) (2.62)
t = 0: T = TПОЧ(Z); C = CПОЧ(Z); (2.63)
До кордонних умов однопараметричної дифузійної моделі (2.58) і (2.59) додаються умови при r = 0 та r =R.
Розглянуті вище моделі використовуються для розрахунку різно-
манітних хімічних реакторів залежно від типу реактора,процесу,який
протікає в ньому і поставленої мети дослідження.
3. ПОБУДОВА МАТЕМАТИЧНОї МОДЕЛІ КАТАЛІТИЧНОГО РЕАКТОРА
3. 1. Етапи побудови математичної моделі
В хімічному реакторі відбуваеться складний процес, що складається взаємодіючих елементарних процесів - хімічних перетворювань та фізичних етапів переносу речовини і тепла. У вигляді прикладу представимо схематично основні складові процесу, що тече у шарі каталiзатора рис. 3.1.
На рисунку 3.1 позначено:
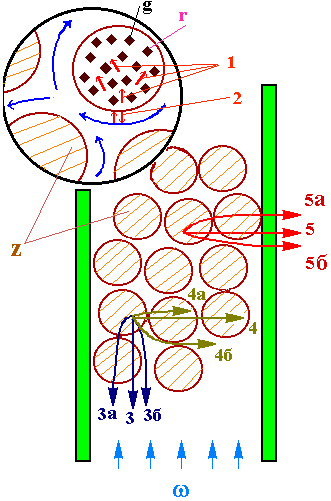 r - хімічна реакція;
r - хімічна реакція;
w - струм реакційної суміші;
z - зерна каталiзатора;
g - глобули каталiзатора;
Процеси переносу:
1- всередині зерна каталiзатора;
2-між поверхнею та струмом суміші;
3 - у продольному напрямі по верстві каталiзатора:
3а – тепла по зернам катталізатора;
3б - речовини і тепла по газової фазі;
4 - у радiальном напрямі по шару каталiзатора:
4а - тепла по зернам каталiзатора
4б - речовини та тепла по газової фазі
5 - тепла від шару каталiзатора до стінки апарату:
5а - від газової фази
5б - від зерен каталiзатора.
Навіть з цієї облегшеноі схеми видно, наскільки складні і різноманітні процеси в шарі каталiзатора. В реакторі, крім деяких шарів каталiзатора, як правило, існують різноманітні теплообміни, смесiтельні та розподільні будови. Отже, реактор можно представити у вигляді багатоступінчастоі структури. Математична модель такого складного об'єкту будує послідовно на основі попередньої побудови моделей його складових частин.
Дослідження складного процесу по частинам дає можливість переходити до моделі більш високого рівня, включаючи в неї як складову частину " вузьку" модель більш низького рівня. Цей перехід є корректним лише в тому випадку, якщо:
– вiдома область зміни перемінних, що цікавить нас, вхідних в " широку " модель більш низького рівня;
– проаналiзована вузька модель всієї цієї областi;
– показано, що "вузька" модель задовільно описує процес на більш низькому рівні.
Для складання математичного опису хiмико-технологічного процесу в реакторі та його дослідження необхідно поділити процес на більш прості частини та установити зв'язки між ними. Можливі різноманітні шляхи виділення рівней і складових частин складного процесу. Для цього, як правило, використовують системний та еволюционний спосіб.
Системний - реактор розглядається як сукупність підсистем, відоброжая при
цьому його iєрархичну (взаiмопідлеглу) будівлю, таким чином надана система розглядається у просторі.
Еволюционний - система (реактор) розглядається в розвитку, в часі.
Послідовність етапів побудови математичної моделі каталiтичного реактора розглянемо на прикладі найбільш расповсюдженного типу хімічних реакторів-реактору з непорушним шаром каталiзатора рис. 3.2.
 |
Рис. 3.2.
Треба визначити, що приведені етапи не задають однозначної послідовностi,
а носять iтераційний характер.
Спершу сформулюємо завдання, що вирішуються на кожному з етапів,
а після цього розглянемо більш докладно деякі з них.
1. Завданням структурного аналізу є вияв та опис структури реактора - виділення рівней більш простих складових складного процесу, протікающего в реакторе, і встановлення зв'язків між ними.
2. Кiнетична модель - сукупність стадій реакцій та дорівнень, що характеризують залежність швидкості реакції від концентрації, температури і тиска у всієї області їх зміни, що охоплює практичні умови реалізації конкретних процесів. Кiнетична модель - основа математичного моделюванiя хімічних процесів і реакторів. На основі кiнетичних закономірностей проводиться визначення оптимальної форми, розмірів і пористоi структури зерен каталiзатора, розрахунок необхідної кількості каталiзатора в заданих умовах, оптiмiзация процесу і дослідження його стійкості, розрахунок статичних і динамічних характеристик процесу.
Дані, необхідні для побудови кiнетичних моделей, одержують внаслідок експериментальних досліджень. Причому обов'язковою вимогою є забезпечення таких умов проведення експерименту досліду, що би цілком виключали вплив процесів переносу речовини і тепла при кiнетичних вимірах, оскільки швидкість реакції повинна однозначно визначитися концентрациямi, температурою і тиском в данний момент.
Засоби обробки експериментальних данних і побудови кiнетичних моделей докладно розглядаються в курсі " Теорія хімічних процесів ".
3. Модель процесу на одiночном зерні каталiзатора будується з урахуваням того, що хімічне перетворення протікає на внутрішньої поверхні пористих зерен каталiзатора, що утворюються багаточiсленними парами різноманітного розміру і форми. Внаслідок виникають процеси переносу речовини і тепла у середині зерен.
Якщо відома детальна структура пор, то, використовуючи математичну модель,
трєба разрахувати швидкість реакції як функцію складу і температури реакційної суміші WН = f (CП, ТП), а також міра використання внутрішньої поверхні.
Математична модель процесу на одiному зерні каталiзатора дозволяє вирішити і зворотне завдання - завбачити оптимальну порiсту структуру, форму і розміри зерен каталiзатора, показники, що забезпечують найкращу його працю.
4. На етапі теоретичної оптiмiзациi визначаються найкращі умови здійснення процесу, не дбаючи про те, чи можутьвони бути реалізовані в реальних апаратах. Початковими даними для проведення всіх розрахунків на наданому етапі служать кiнетичнi дані. Одержані теоретичні оптимальні умови використовуються на наступних етапах - попереднього вибору типу реактора і технико - економічних розрахунків.
5. Попередній вибір типу реактора проводиться на основі знайденого теоретичного оптимального режиму. Як правило, використовуючи математичні моделі, проводиться розрахунок деяких можливих варіантів і обирає той з них, що
дозволяє найбільш повно реалізувати теоретично оптимальний режим.
6. Стійкість процесу має істотне значення при виборі конструкції апарату.
Проблема дослідження стійкості виникає при здійсненні екзотемічних реакцій. Якщо при проектуванні обирати режими реактора тільки з умов матеріального і теплового балансів та інтенсивності теплообміну, то можно легко зробити помилку, запроектувавши нестійкій режим.
Визначення параметричної чутливості необхідно для прогнозу поведінки реактора при різноманітних флуктуаціях вхідних параметрів, а також для вибору каналу управління технологічним режимом опрацювання системи автоматичного регулювання.
7. На етапі проектування реактора, використовуючи одержані раніше результати з обліком технологічних умов, обмежень і економічних даних, виробляє остаточний вибір технологічної схеми реактора, режиму його роботи і розрахунок необхідної кількості каталiзатора. Залежно від особливостей процесу та міри його вивченності обирає масштаб першого досвідчено-промислового реактора.
8. Гідравлічне моделювання проводиться для визначення і подальшого усунення можливих відхилень від заданого технологічного режиму, обумовленних неоднорідністю умов подогріва або охолодження, неравномірністю підвода реакційної суміші в реактор, неоднорідностю прохідного струму крізь шар каталiзатора та ін. Як правило, гідравлічне моделювання проводиться на фізичних моделях при виконанні умов геометричної і гідродинамічної подібності.
3. 2. Структурний аналіз
У вигляді прикладу розглянемо структурний аналіз процесу,протікающого в
реакторі з непорушним шаром каталiзатора рис. 3.3.

Рис 3.3
Першим рівнем, що складається із окремих стадій хімічного перетворення, служить знакова модель складної хімічної реакції, протікающій в кiнетичній області в відсутності процесів переносу тепла і речовини. Дорівнення, що описують швидкість хімічного перетворення (кiнетична модель), входять як складні в модель другого рівня - модель процесу на одiночном зерні каталiзатора.
Складовими частинами цього рівня є також стадії переносу речовини та тепла у середині зерна каталiзатора. Зв'язки між окремими складовими описуються дорівненнями матеріального і теплового балансів. Третій рівень - модель процесу у шарі каталiзатора урахуванням процесів переносу речовини і тепла як по шару каталiзатора, так і до зовнішньої поверхнi зерен. Модель другого рівня - швидкість, що спостерігає хімічне перетворення - входить у модель третього рівня як складова частина.
Модель четвертого рівня - модель реактора з урахуванням розміщення окремих прошарків каталiзатора, теплообмінних, смесiтельних та інших вузлів. Модель процесу в шарі каталiзатора (модель третього рівня) входить як складова до моделі четвертого рівня.
Уявляючи реактор у вигляді багатоступінчастоу моделі, ми поділяємо складний процес на більш прості составні і одержуємо можливість проводити вивчення по частинам і влаштовувати зв'язк між окремими частинами.
Можливі різноманітні шляхи виділення рівней і складових частин складного процесу у реакторі. Проте всі раздроблення повинні відповідати принципу iнварiантностi складових частин до масштабу, що укладає в наступному –
закономірністi протіканiя процесів в складових частинах наданого рівня моделі не повинні залежати від масштабу рівня, що роздивляється, а вплив масштабу слід враховуватися взаємодією між складовими частинами і краєвими умовами.
Необхідно визначити, що в цьому визначенні промова іде про iнварiантностi
саме закономірності протікання процесів на нижньому рівні до процесівна більш високому рівні, а не про iнварiантностi кількісних залежностій. Так, зміна масштабу більш високого рівня може значно деформувати кількісну картину на більш низькому рівні, проте залежность протіканiя процесів залишаться минулими.
При дотриманні принципу iнварiантностi одержані суммарні залежності про теканiя процесу на нижньому рівні будуть входити як складні наступного рівня моделі і не будуть залежати від його масштабу. Наприклад, закономірностi протеканiя процесів в складових частинах моделі другого рівня – порiстого зерна каталiзатора – перенос речовини і тепла у середині пор каталiзатора і швидкісті хімічного перетворення не залежать від масштабів зерна. Вплив же масштабу на розподіл концентраций і температури по радіусу зерна визначаються краєвими умовами і характером тепло- і массообміну між зовнішньої поверхні зерна і ядром струму. Одержані залежності що спостерігаються швидкості реакцій на порiстому зерні не залежать від масштабу наступного рівня - слоя каталiзатора і входять
в нього як складова частина математичної моделі процесів, протікающих в шарі каталiзатора.
3. 3. Моделювання процесу на одному зерні каталiзатора
У всякому гетерогенному процесі взаємодія між компонентами діється на поверхнi розділу фаз чи в безпосередньоу близькості від неї. Тому сучасні каталiзатори становлять порiсті матеріали з високорозвиненою внутрішньою поверхністью. Головна причина, що змушує застосовувати подібні каталiзатори це багаторазове збільшення поверхнi розділу фаз. Так, якщо непорiста гранула діаметром 5 мм має поверхність порядку 10-4 м2, то поверхність пор в порiстої гранулі такого ж розміру може складати 20-600 м2, т.ч. різниця може досягати 105 раз.
Картина процесу, протекающого в порiстом зерні каталiзатора відрізняється великою складністю, тому що діфузія речовини проходить в вузьких порах, форма і перетин яких непостоянні. Для аналізу процесів в зерні каталiзатора була запропонована достатньо проста схема - квазiгомогенная модель. Відповідно до цього зерно розглядається не як складна система пор, а як деяке суцільне непоруш-не середовище, всередині якого іде дифузія реагентів (обумовлена ефективним коефіціентом дифузії 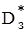 ) і в якій протікає хiмiчеська реакція (визначаєма константой швидкості реакції, віднесенноу до одиниці обсягу зерна KЗ). При цьому, якщо реакція іде при постійній температурі, то значення
) і в якій протікає хiмiчеська реакція (визначаєма константой швидкості реакції, віднесенноу до одиниці обсягу зерна KЗ). При цьому, якщо реакція іде при постійній температурі, то значення 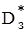 і К3 вважаються однаковими в всіх крапках зерна.
і К3 вважаються однаковими в всіх крапках зерна.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 693; Нарушение авторских прав?; Мы поможем в написании вашей работы!