
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Нафтоли 2 страница
|
|
|
|
Серед біциклічних похідних особливе значення має α-пінен і камфора. α-Пінен - рідина, tкип.=156оС. Він є основною складовою частиною скипидару, має запах соснової хвої. Використовується як розчинник лаків і фарб. Камфора використовується як ліки, а також як пластифікатор при одержанні целюлози.
АРОМАТИЧНІ ВУГЛЕВОДНІ
Лекція №5 (2 години)
1. Загальна характеристика класу аренів.
2. Будова, ізомерія, номенклатура одноядерних аренів.
3. Природні джерела та способи добування аренів.
4. Фізичні властивості ароматичних вуглеводнів.
Ключові слова: ароматичні вуглеводні, одноядерні арени, бензол, ароматичний зв'язок, бензольне ядро, шестиелектронний π-зв’язок, орто-, мета-, пара- ізомери, ароматизація нафти, канцерогенні речовини.
Література: [1] с. 75 - 83; [3] с. 185 – 192
1. Загальна характеристика класу аренів
Арени – вуглеводні, в молекулах яких міститься циклічне угрупування (бензольне кільце), атоми Карбону якого сполучені між собою ароматичним зв’язком. Найпростішим представником аренів є бензол С6Н6.
Класифікація аренів: одноядерні та багатоядерні ароматичні вуглеводні, які мають два або більше бензольних кілець.
2. Будова, ізомерія, номенклатура одноядерних аренів
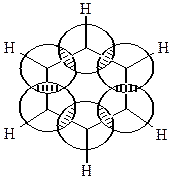
Будова бензолу в світі сучасних уявлень про природу хімічних зв’язків. Сучасна структурна формула бензолу.
Молекула бензолу має форму правильного плоского шестикутника. Усі атоми Карбону в бензольному циклі знаходяться в стані sp2-гібридизації. Кожний з них утворює три звичайних σ-зв’язки (за рахунок трьох гібридних орбіталей), які розташовані у просторі під кутом 120о. Негібридизовані р-орбіталі кожного атома Карбону орієнтовані перпендикулярно до площини бензольного кільця і перекриваються між собою над і під кільцем. В результаті виникає спільна електронна хмара і утворюється єдиний хімічний π-зв’язок для всіх атомів Карбону. Таким чином, шість π-електронів не локалізовані в пари, а утворюють єдину π-систему.
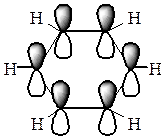
| 
|
Таким чином, молекула бензолу - стійкий симетричний шестичленний цикл з однаковими СН-групами, які знаходяться в одній площині і зв’язані ароматичною системою зв’язків.
Гомологи бензолу. Ізомери двозаміщених аренів: орто -, мета -, пара - ізомери).
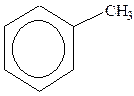
| 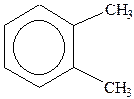
| 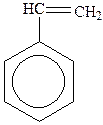
| 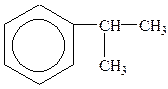
|
| толуол | о-ксилол | стирол (вінілбензол) | кумол (ізопропілбензол) |
3. Природні джерела та способи добування аренів
Природні джерела ароматичних сполук: кам’яновугільна смола, коксовий газ. Арени також одержують ароматизацією нафти (каталітичне дегідрування циклоалканів, дегідроциклізація алканів).
Синтез гомологів бензолу можна здійснювати за реакціями Вюрца-Фіттіга, Фріделя-Крафтса, тримеризації ацетилену, лужного сплавлення солей ароматичних кислот.
Синтез Вюрца-Фіттіга (1864 р.):
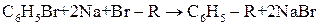
| |
| Бромбензол | Алкілбензол |
Реакція Фріделя-Крафтса:
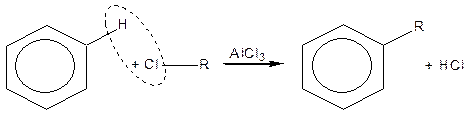
| |
| Бензол | Алкілбензол |
Сплавлення солей ароматичних кислот з лугами
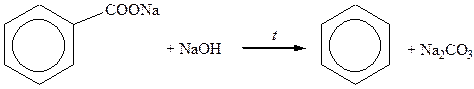
|
4. Фізичні властивості ароматичних вуглеводнів
Арени – малополярні сполуки і їхні фізичні властивості аналогічні властивостям аліфатичних вуглеводнів, які залежать від розміру та ізомерії замісників. Бензол та його найближчі гомологи – безбарвні рідини з характерним запахом, вищі гомологи – тверді речовини. Вони нерозчинні у воді, але добре розчиняються в органічних розчинниках. Легко загоряються і горять світним, сильно кіптявим полум’ям. Рідкі арени самі є гарними розчинниками органічних сполук. Пари та рідини токсичні, деякі речовини – канцерогенні.
ВЛАСТИВОСТІ АРЕНВ. БАГАТОЯДЕРНІ АРОМАТИЧНІ СПОЛУКИ
Лекція №6 (2 години)
1. Хімічні властивості аренів.
2. Окремі представники, похідні, їх значення і використання.
3. Арени з конденсованими циклами, їх будова, хімічні властивості.
4. Багатоядерні сполуки з неконденсованими циклами, їх будова, хімічні властивості.
Ключові слова: реакції електрофільного заміщення, замісники першого роду, замісники другого роду, орієнтуюча дія, багатоядерні арени, конденсовані цикли, нафталін, антрацен, фенатрен, ізольовані бензольні цикли, дифеніл.
Література: [1] с 75 – 110; [3] с. 185 - 209; [13]
1. Хімічні властивості аренів
Реакції електрофільного заміщення  (алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.
(алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.
Правила заміщення в бензольному кільці. Якщо в бензольному ядрі є замісник, тоді інший замісник займає положення, яке залежить від характеру першого. Всі замісники за характером їх орієнтуючої дії поділяють на дві групи.
Замісники першого роду – галогени, вуглеводневі радикали, гідроксильна і заміщена гідроксильна група, аміно- і заміщена аміногрупа – є орто -, та пара -орієнтантами. Замісники другого роду – карбоксильна група, альдегідна, сульфо-, нітро- групи та інші – мета- орієнтанти.
Орієнтуюча дія замісників пояснюється їх різним впливом на реакційну здатність бензольного ядра. Замісники першого роду (крім галогенів) збільшують електронну густину бензольного ядра і таким чином активізують й поляризують його, в результаті чого на атомах Карбону в орто - і пара -положеннях виникає частково від’ємний заряд. Реакції заміщення прискорюються. Замісники другого роду зменшують електронну густину ядра і менше за все на атомах Карбону в мета -положеннях, внаслідок чого це положення стає найбільш реакційно здатним.
Вплив замісників на бензольне кільце.
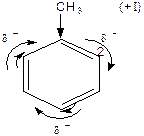
| 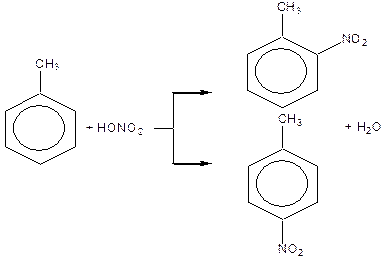
|
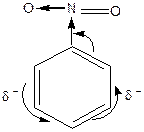
| 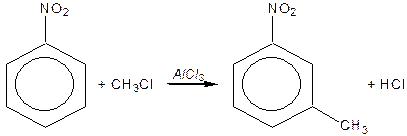
|
Необхідно відмітити, що ці правила не мають абсолютного значення. У більшості
реакцій поряд з переважною кількістю основного продукту реакції (згідно з правилами) утворюються й інші ізомери, в значно меншій кількості.
Реакції приєднання: гідрування, фотохімічне хлорування.
Окиснення бензолу та його гомологів
Бензол дуже стійкий до окисників. За звичайних умов він не знебарвлює розчин калій перманганату 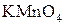 .
.
В умовах дії окисників на гомологи бензолу окисненню піддається боковий ланцюг, який під час окиснення «згоряє», за виключенням найближчого до ядра атому Карбону, що окиснюється до карбоксильної групи:
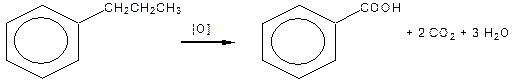
|
| Бензойна кислота |
2. Окремі представники, їх значення та використання
Бензол, толуол, ксилоли, кумол та стирол.
3. Багатоядерні арени з конденсованими циклами, їх будова, хімічні властивості.
Нафталін, фенантрен, антрацен. Їх будова, хімічні властивості
(гідрування, електрофільне зміщення, окиснення).
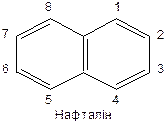
|
Положення 1, 4, 5, 8 – a -положення; положення 2, 3, 6, 7 – b -положення.
Нафталін виявляє ароматичний характер у реакціях заміщення (галогенується, нітрується, сульфується), які відбуваються як правило в a -положенні.
Гідрування нафталіну з утворенням тетраліну і декаліну.
Окиснення нафталіну відбувається легше, ніж бензолу. У цьому випадку одне з бензольних ядер руйнується, а його a -карбонові атоми перетворюються на карбоксильні групи. Проміжним продуктом є a -нафтохінон.
Антрацен, фенантрен виявляють ароматичний характер, легко вступають також у реакції приєднання. Надактивними є положення 9, 10 (мезо -).
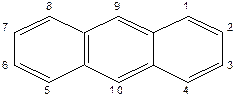
|
Альфа — (1, 4, 5, 8), бета — (2, 3, 6, 7), мезо — (9, 10)
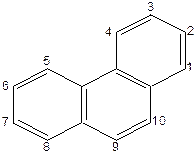
|
| Фенантрен |
Сам фенантрен не становить практичного інтересу, але багато складних природних сполук, які мають фізіологічне значення, містять фенантренове кільце. Це стероїди, полові гормони, вітамін D, алкалоїди тощо.
Вуглеводні з багатьма конденсованими бензольними ядрами. Поняття про канцерогенні вуглеводні.
4. Багатоядерні арени з ізольованими бензольними ядрами, їх будова, хімічні властивості.
Найпростішою сполукою цієї групи є дифеніл:
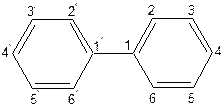
|
Дифеніл — речовина ароматичного характеру, легко нітрується, сульфується (реакції 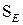 ) з утворенням головним чином пара -ізомерів.
) з утворенням головним чином пара -ізомерів.
Прикладами аренів з ізольованими ядрами є дифенілметан і трифенілметан.
Дифенілметан має приємний запах, подібний запаху апельсину, внаслідок чого його використовують в парфумерії. Аміно- й оксипохідні трифенілметану є відомими барвниками - малахітовий зелений, кристалічний фіолетовий тощо.
Змістовий модуль 2 Основні класи органічних сполук
ГІДРОКСИСПОЛУКИ. СПИРТИ
Лекцїя № 7 (2 години)
1. Загальна характеристика гідроксисполук.
2.Будова, ізомерія, номенклатура одноатомних спиртів.
3.Способи добування одноатомних спиртів.
4. Фізичні властивості спиртів.
5. Хімічні властивості одноатомних спиртів.
6. Окремі представники, їх значення і використання.
Ключові слова: гідроксисполуки, одноатомні спирти, функціональна група, гідроксильна група, водневий зв'язок, асоціація, контракція спирту, алкоголяти, етери, естери, дегідрування, багатоатомні спирти, дегідратація.
Література: [1] с. 111 - 123; [3] с. 227 – 246
Загальна характеристика гідроксисполук
Спирти - похідні вуглеводнів, в молекулах яких один або декілька атомів Гідрогену заміщені гідроксильними групами. Класифікація спиртів залежно від природи радикала та кількості гідроксильних груп. Насичені одноатомні спирти.
2. Будова, ізомерія, номенклатура одноатомних спиртів
Алканоли – одноатомні спирти. Первинні, вторинні, третинні спирти.
3. Способи добування одноатомних спиртів
Способи добування: приєднання води до алкенів (гідратація); гідроліз галогенопохідних вуглеводнів; відновлення карбонільних сполук; бродіння вуглеводів та ін.
4. Фізичні властивості одноатомних спиртів
Загальні зміни фізичних властивостей (густина, температури кипіння й плавлення тощо), характерні для вуглеводнів, проявляються і в спиртах. Але їх температури кипіння суттєво вищі, ніж алканів і галогеналканів з тією самою кількістю атомів Карбону. Це пояснюється наявністю водневих зв’язків, які сприяють існуванню асоціатів між молекулами спирту (так само, як і для води):
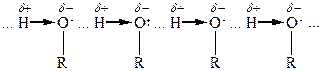
|
Залежно від будови первинні спирти мають вищу температуру кипіння, ніж вторинні, які, у свою чергу, характеризуються більшою температурою кипіння порівняно з третинними.
Контракція спирту.
5. Хімічні властивості одноатомних спиртів
Хімічні властивості спиртів обумовлені наявністю функціональної групи -ОН. Електронний характер гідроксильної групи визначає її здатність до реакцій гетеролітичного типу, внаслідок яких може розриватися або зв’язок С-О, або О-Н.
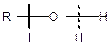
|
Отже, спирти, як і вода, виявляють амфотерні властивості, хоча і дуже слабкі. Спирти — нейтральні речовини, не змінюють забарвлення лакмусу, не реагують ні з розведеними кислотами, ні з розведеними основами.
Кислотні властивості
Визначаються легкістю відриву Н+ від гідроксигрупи. Спирти активно реагують із лужними металами, менш активно — із лужноземельними, магнієм і алюмінієм. Ці реакції відносяться до реакцій заміщення —виділяється водень і утворюються солі — алкоголяти (алканоати):
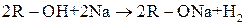
Алкоголят Na
Як солі слабких кислот і сильних основ, алкоголяти гідролізуються у розчині, створюючи лужне середовище:
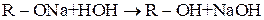
Основні властивості
Спирти взаємодіють із сильними кислотами:
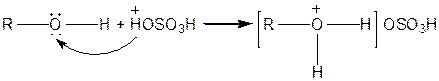
|
| Сіль алкілгідроксонію |
Такі солі нестійкі.
Реакції заміщення гідроксигрупи на галоген
Дія галогеноводнів на спирти — одна з найважливіших реакцій нуклеофільного заміщення:
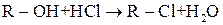
Заміщення гідроксилу на галоген відбувається і в умовах дії наступних сполук:  ,
, 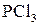 ,
, 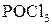 ,
, 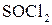 . Найлегше реагують третинні спирти.
. Найлегше реагують третинні спирти.
Утворення етерів
Утворення етерів (простих ефірів) відбувається за рахунок відщеплення молекули води від двох молекул спирту в умовах нагрівання і у присутності водовіднімаючих засобів:
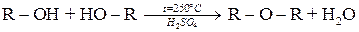
За більш м’якими умовами реакція утворення етерів перебігає внаслідок взаємодії алкоголята з галогеналканом.
Утворення естерів
Естери (складні ефіри) утворюються під час взаємодії кислоти і спирту. Наприклад,
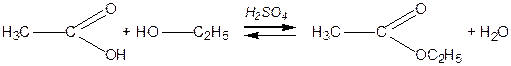
| ||
| Оцтова кислота | Етанол | Етилацетат |
Окиснення спиртів
Якщо спирт підпалити, він згоряє з утворенням води та вуглекислого газу:
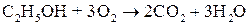
Під дією інших окисників (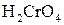 ;
; 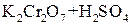 ;
; 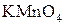 ;
; 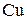 ) спирти окиснюються і утворюють різні продукти: первинні спирти окиснюються до альдегідів, вторинні спирти - до кетонів, окиснення третинних спиртів супроводжується розривом карбонового ланцюга, як правило, біля атому Карбону, що має гідроксильну групу.
) спирти окиснюються і утворюють різні продукти: первинні спирти окиснюються до альдегідів, вторинні спирти - до кетонів, окиснення третинних спиртів супроводжується розривом карбонового ланцюга, як правило, біля атому Карбону, що має гідроксильну групу.
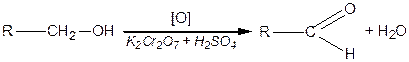
|
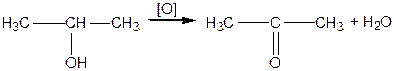
|
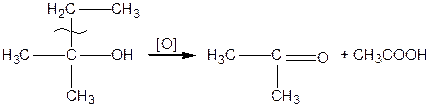
|
Дегідрування спиртів
Дегідрування спиртів відбувається під час пропускання пари спирту над дегідруючим каталізатором (розжарена мідь, залізо, нікель). У цьому випадку первинні спирти перетворюються на альдегіди, вторинні — на кетони.
Дегідратація спиртів
Дегідратація спиртів у залежності від умов може бути внутрішньомолекулярною (утворення олефінів) і міжмолекулярною (утворення етерів).
6. Окремі представники, їх значення і використання
Метанол, етанол, пропілові, бутилові, вищі жирні спирти.
НЕНАСИЧЕНІ СПИРТИ. БАГАТОАТОМНІ СПИРТИ
Лекцїя № 8 (2 години)
1. Ненасичені одноатомні спирти.
2. Багатоатомні спирти, їх будова, ізомерія, номенклатура.
3. Способи добування багатоатомних спиртів.
4. Фізичні та хімічні властивості багатоатомних спиртів.
5. Окремі представники багатоатомних спиртів, їх значення
і використання.
Ключові слова: ненасичені спирти, полімеризація, вініловий спирт, полівінілацетат,, багатоатомні спирти, гліцерати, дегідратація, діоксан, акролеїн.
Література: [1] с. 123 - 135; [3] с. 246 – 256
1. Ненасичені одноатомні спирти
Ненасичені одноатомні спирти – можуть бути етиленового (алкеноли) або ацетиленового (алкіноли) ряду. Найважливіше значення мають спирти етиленового ряду. Одержання етерів та естерів вінілового спирту 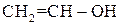 з ацетилену:
з ацетилену:
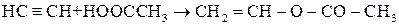
Такі сполуки мають подвійний зв’язок і легко полімеризуються:
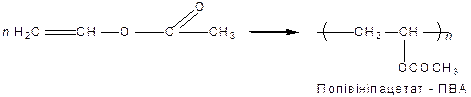
|
2. Багатоатомні спирти, їх будова, ізомерія, номенклатура
Багатоатомні спирти — гідроксисполуки, молекулах яких містять дві та більш гідроксильні групи: двоатомні (діоли); триатомні (триоли) тощо. Спирти, які б мали дві або три гідроксигрупи біля одного атому Карбону нестійкі, виділити їх неможливо.
3. Способи добування багатоатомних спиртів
гідроліз відповідних дигалогенопохідних;
реакція Вагнера;
гідроліз жирів.
4. Фізичні та хімічні властивості багатоатомних спиртів
Багатоатомним спиртам характерні властивості одноатомних спиртів, але відповідні реакції відбуваються як за однією, так і за іншими гідроксигрупами. Взаємний вплив гідроксигруп посилює рухливість їх атомів Гідрогену, внаслідок чого багатоатомні спирти мають більш виражені кислотні властивості ніж одноатомні спирти. Вони реагують не тільки з металічним натрієм, а й з лугами, розчиняють осад 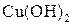 , утворюючи комплексну сполуку Купруму – Купрум(ІІ) гліколят — розчин темно-синього кольору.
, утворюючи комплексну сполуку Купруму – Купрум(ІІ) гліколят — розчин темно-синього кольору.
Це якісна реакція на багатоатомні спирти:
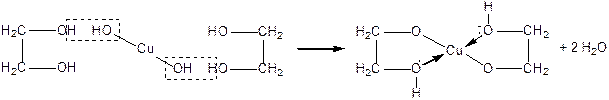
|
Дегідратація спиртів залежить від будови гліколю та умов реакції:
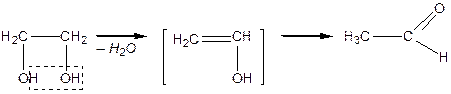
|
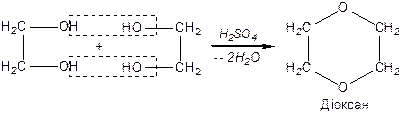
|
Поліконденсація гліколю:
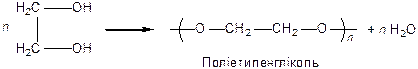
|
Дією на гліцерин водовіднімаючих засобів або нагріванням добувають ненасичений альдегід — акролеїн із характерним запахом горілого жиру:
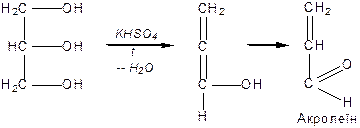
|
5. Окремі представники, їх значення та використання
Етиленгліколь утворює незамерзаючі за низьких температур водні й спиртові розчини — антифрізи, що заміняють воду в радіаторах двигунів; використовується для синтезу лавсану тощо.
Гліцерин утворює естери як з мінеральними кисневмісними кислотами, так і з органічними. Важливим продуктом є азотнокислий ефір гліцерину (нітрогліцерин), який використовується в медицині, для виготовлення динаміту. Використання гліцерину: у медицині, текстильній, харчовій промисловості, для виробництва пластмас (гліфталеві смоли).
Поняття про спирти вищої атомності. Ксиліт. Сорбіт.
Лекція №9 (2 години)
1. Будова, ізомерія, номенклатура фенолів.
2. Поширення у природі та способи добування.
3. Фізичні та хімічні властивості фенолів.
4. Окремі представники, їх значення і використання.
5. Нафтоли.
Ключові слова: одноядерні феноли, крезол, кумольний спосіб, антисептичні властивості, поліконденсація, феноло-формальдегідна смола, хінон, перекисний радикал, антиоксиданти, поліфенольні сполуки, нафтоли.
Література: [1] с. 135 - 149; [3] с. 256 - 271
1. Будова, ізомерія, номенклатура фенолів
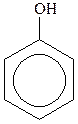
Феноли – похідні ароматичних вуглеводнів, у молекулах яких один або декілька атомів Гідрогену ароматичного ядра заміщені на гідроксильні групи, наприклад:
| 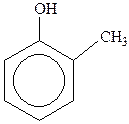
| 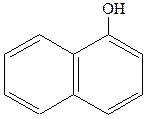
| 
|
| фенол (гідроксибензол) | 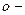 крезол ( крезол (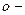 гідрокситолуол) гідрокситолуол)
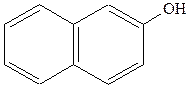
|  нафтол (1-нафтол або нафтол (1-нафтол або  гідроксинафталін) гідроксинафталін)
| 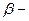 нафтол (2-нафтол або нафтол (2-нафтол або 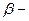 гідроксинафталін) гідроксинафталін)
|
Залежно від кількості гідроксильних груп розрізняють одно-, дво-, триатомні тощо феноли.
Ізомерія фенолів зумовлена розташуванням гідроксигруп в ароматичній сполуці, будовою і положенням замісників. Назви фенолів утворюють із назв відповідних аренів, додаючи закінчення 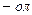 . Нумерацію атомів Карбону в ароматичному ядрі починають з атома, біля якого знаходиться гідроксигрупа. Та поряд із зазначеними багато фенолів зберегли тривіальні назви, які досі широко використовуються.
. Нумерацію атомів Карбону в ароматичному ядрі починають з атома, біля якого знаходиться гідроксигрупа. Та поряд із зазначеними багато фенолів зберегли тривіальні назви, які досі широко використовуються.
2. Поширення у природі та способи добування
Способи добування: із кам’яновугільної смоли; лужне сплавлення солей бензолсульфокислот; кумольний спосіб.
3. Фізичні та хімічні властивості фенолів
Одноатомні феноли – прозорі рідини або кристалічні речовини. У разі попаданні на шкіру викликають опіки. Фенол – отруйна речовина, має сильні антисептичні властивості.
Хімічні властивості фенолів та нафтолів обумовлені наявністю в їх молекулах гідроксигрупи та ароматичного ядра. Вони вступають у численні реакції, характерні для цих груп, а також у реакції, що зумовлені їх взаємним впливом. Але фенолам характерні більш виражені кислотні властивості, ніж спиртам. Це пояснюється тим, що шість електронів бензольного ядра, які утворюють єдину 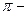 електронну систему, відтягують на себе електрони атому Оксигену гідроксильної групи, внаслідок чого електронна густина зв’язку
електронну систему, відтягують на себе електрони атому Оксигену гідроксильної групи, внаслідок чого електронна густина зв’язку 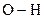 зміщується від атома Гідрогену до атома Оксигену, зв’язок стає більш полярним, зростає можливість відщеплення атома Гідрогену у вигляді протона.
зміщується від атома Гідрогену до атома Оксигену, зв’язок стає більш полярним, зростає можливість відщеплення атома Гідрогену у вигляді протона.
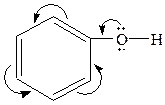
|
Тому феноли утворюють феноляти не тільки під дією металів, але і під дією лугів, а також ферум (ІІІ) хлориду:
Для фенолів характерні реакції заміщення в бензольному кільці. В результаті взаємодії фенолу з бромною водою утворюється 2,4,6-трибромфенол — осад білого кольору. Це якісна реакція на феноли.
Феноли вступають в реакцію конденсації з альдегідами як в кислому, так і в лужному середовищі за рахунок атомів Гідрогену в орто - та пара - положеннях. Однією з найважливіших реакцій є реакція поліконденсації фенолу з формальдегідом з утворенням фенолоспиртів із подальшим утворенням феноло-формальдегідної смоли.
Фенол добре гідрується в присутності нікелевого каталізатору за температури 150°С з утворенням циклогексанолу. Феноли легко окиснюються із утворенням суміші різних продуктів окиснення.
Якісною реакцією на феноли є реакція з ферум(ІІІ) хлоридом: фенол дає фіолетове забарвлення; крезоли – синьо-блакитне; багатоатомні феноли – забарвлення різних відтінків.
4. Окремі представники, їх значення і використання
Фенол, крезоли. Двоатомні та триатомні феноли.
Поширення фенольних сполук у природі та вміст у харчових продуктах. Фенольні антиоксиданти. Здатність фенолів до окиснення є важливою властивістю, тому що дає можливість використовувати їх як антиоксиданти (антиокисники). Феноли взаємодіють з перекисними радикалами, що утворюються під час окиснення, внаслідок чого утворюються малоактивні радикали, які не здатні продовжувати ланцюг окислення.
Із гідроксильних похідних нафталіну найважливішими є a - та b - нафтоли:
Нафтоли виявляють властивості фенолів: розчиняються в лугах, дають забарвлення з ферум(ІІІ) хлоридом (a -нафтол — фіолетове; b -нафтол —зелене).
У промисловості їх одержують лужним плавленням натрієвих солей відповідних сульфокислот.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2412; Нарушение авторских прав?; Мы поможем в написании вашей работы!