
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа. Универсальная газовая постоянная
|
|
|
|
На основании законов Бойля-Мариотта и Гей-Люсака в 1834г Клапейроном было выведено уравнение состояния идеальных газов.
Из уравнений (1.1) и (1.2) следует, что p = n k T, (2.14)
Уравнение (2.14) наз. основным уравнением кинетической теории газов. Рассмотрим
1 кг газа. Учитывая, что в нём содержится N молекул и, следовательно, n = N/v
получим: p v = N k T, (2.15)
Постоянную величину N k, отнесённую к 1 кг газа, обозначают буквой R и наз. газовой постоянной, R,(Дж/кг К).
Поэтому p v = R T, (2.16)
Это уравнение наз. уравнением Клапейрона.
Умножив уравнение (2.16) на массу m, получим уравнение состояния для произвольной массы газа: pv=mRT, (2.17)
Уравнение Клапейрона принимает универсальную форму, если газовую постоянную отнести не к 1 кг, а 1 кмолю газа.
Умножая обе части уравнения (2.16) на молекулярную массу, получим:
р v 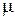 =
= 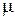 R T, (2.18) или p V
R T, (2.18) или p V 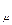 = R
= R 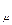 T, (2.19)
T, (2.19)
где V 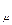 -молярный объём газа, м3/кмоль; R
-молярный объём газа, м3/кмоль; R 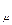 -универсальная газовая постоянная, (Дж/(кмоль К)), где:
-универсальная газовая постоянная, (Дж/(кмоль К)), где: 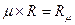
Уравнение (2.19) в 1874г. получено Д. И. Менделеевым и носит название уравнения состояния для 1кмоля газа или уравнения Менделеева – Клапейрона.
Универсальная газовая постоянная R  , входящая в уравнение (2.19) не зависит от
, входящая в уравнение (2.19) не зависит от
природы вещества и для всех идеальных газов в любом состоянии имеет одно и то же значение. Она может быть вычислена из уравнения (2.19). Так при нормальных физических условиях (НФУ) – это такие, при которых р =101325 Па = 760 мм рт. ст; Т = =273,15 К; V 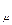 = 22,4 м3 /кмоль.
= 22,4 м3 /кмоль.
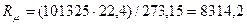 , Дж/(кмоль К), (2.20)
, Дж/(кмоль К), (2.20)
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 605; Нарушение авторских прав?; Мы поможем в написании вашей работы!