
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия как параметр состояния термодинамической системы
|
|
|
|
Термин энтропия (от греч. entropia – мера превращений) введен в 1865 году Клаузиусом.
Понятие об энтропии строится на основе следующих соображений.
Уравнение 1-го закона ТТД имеет вид: 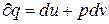 или
или 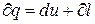
В этом уравнении 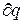 не явл. полным дифференциалом, поскольку в правую часть уравнения входит член
не явл. полным дифференциалом, поскольку в правую часть уравнения входит член 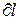 , не являющийся полным дифференциалом, т.к. работа не явл. параметром состояния газа, а функцией процесса (т.е. чтобы проинтегрировать правую часть этого выражения нужно знать зависимость р от v, т.е. процесс, который совершает газ). Вследствие этого уравнение нельзя проинтегрировать в интервале двух произвольно выбранных состояний газа.
, не являющийся полным дифференциалом, т.к. работа не явл. параметром состояния газа, а функцией процесса (т.е. чтобы проинтегрировать правую часть этого выражения нужно знать зависимость р от v, т.е. процесс, который совершает газ). Вследствие этого уравнение нельзя проинтегрировать в интервале двух произвольно выбранных состояний газа.
Как известно из математики, всякий двучлен можно представить в виде полного дифференциала, если его умножить на так наз. интегрирующий множитель. Таким интегрирующим множителем для элементарного количества теплоты 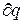 явл. 1/Т, т.е. получаем:
явл. 1/Т, т.е. получаем: 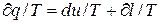 , (3.17)
, (3.17)
Уравнение (3.17) можно представить в ином виде:
dS = 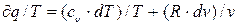 , т.к.
, т.к. 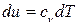 а р/Т=R/V, (3.18)
а р/Т=R/V, (3.18)
Выражение 3.18 говорит о том, что 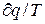 представляет собой полный дифференциал некоторой функции S, т.е.
представляет собой полный дифференциал некоторой функции S, т.е. 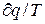 =dS явл. параметром состояния газа, поскольку она зависит только от двух параметров газа и поэтому не зависит от того, каким путем газ из одного состояния перешел в другое. Этот параметр состояния газа наз. энтропией и обозначается через S и имеет размерность Дж/К. Энтропию, отнесенную к 1 кг газа наз. удельной энтропией газа, обозначается s и измеряется в Дж/кг К.
=dS явл. параметром состояния газа, поскольку она зависит только от двух параметров газа и поэтому не зависит от того, каким путем газ из одного состояния перешел в другое. Этот параметр состояния газа наз. энтропией и обозначается через S и имеет размерность Дж/К. Энтропию, отнесенную к 1 кг газа наз. удельной энтропией газа, обозначается s и измеряется в Дж/кг К.
Проинтегрировав обе части равенства (3.18) по любому пути перехода из состояния 1 в состояние 2, получим: 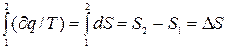 , (3.19)
, (3.19)
Из сказанного следует, что энтропия есть функция любой пары параметров состояния:
S=f1 (p,T); S=f2 (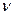 ,T); S=f3 (p,
,T); S=f3 (p, 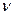 ); S=f4 (u,
); S=f4 (u, 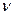 ); S=f5 (h, T); и т.д.
); S=f5 (h, T); и т.д.
В обратимых процессах dS и dq имеют одинаковый знак, т.к. Т имеет только положительный знак. Тогда при подводе теплоты к рабочему телу 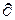 q>0 энтропия увеличивается, при отводе теплоты
q>0 энтропия увеличивается, при отводе теплоты 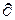 q<0 - энтропия уменьшается, в процессе без отвода и подвода теплоты
q<0 - энтропия уменьшается, в процессе без отвода и подвода теплоты 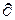 q=0 (адиабатный процесс) энтропия остается постоянной dS=0.
q=0 (адиабатный процесс) энтропия остается постоянной dS=0.
|
|
|
Таким образом по характеру изменения энтропии можно судить о направлении процесса переноса теплоты.
Из (3.18) следует, что количество теплоты, участвовавшее в том или ином ТД процессе при изменении состояния рабочего тела от состояния 1 до состояния 2 можно выразить следующим образом: 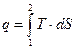 , (3.20)
, (3.20)
3.6. Тепловая T,S – диаграмма
Понятие энтропии позволяет ввести чрезвычайно удобную для ТД расчетов T,S – диаграмму, рис.3.3. Любой обратимый ТД процесс, изображенный в p, v – диаграмме, может быть перенесен в T,S – диаграмму. Для этого надо знать уравнение процесса f (p, v)=0, и зависимость S=f (p, v) энтропии от параметров состояния p и v. Для отыскания точки процесса на диаграмме по уравнению состояния и известным значениям v и p определяют температуру Т и значение энтропии S.
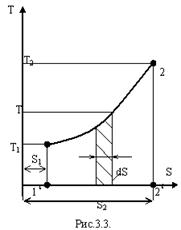 T,S – диаграмма дает представление о количестве теплоты, подведенной или отведенной к рабочему телу в процессе в виде площади под процессом (пл.1-2-2
T,S – диаграмма дает представление о количестве теплоты, подведенной или отведенной к рабочему телу в процессе в виде площади под процессом (пл.1-2-2 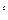 -1
-1 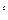 ).Это следует из уравнения
).Это следует из уравнения 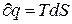 .
.
По T,S – диаграмме можно судить также о направлении теплообмена между источником теплоты и рабочим телом.
Как уже отмечалось, направление теплового потока должно совпадать с алгебраическим знаком dS, т.к. абсолютная температура Т – всегда положительная величина. Таким образом, обратимый процесс с увеличением энтропии идет с подводом теплоты, а обратимый процесс с уменьшением энтропии идет с отводом теплоты от рабочего тела.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 814; Нарушение авторских прав?; Мы поможем в написании вашей работы!