
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Политропный процесс
Основные термодинамические процессы идеальных газов
ЛЕКЦИЯ 4
ТД анализ любой системы состоит в следующем:
1. Выявить уравнение процесса. 2. Установить аналитическую взаимосвязь между
параметрами состояния, (связь между параметрами p, v, T, S, т.е. уравнения: p=f1 (v), T=f2 (v), T=f3 (p), S=f4 (T)). 3. Рассчитать величину работы изменения объема рабочего тела.4. Рассчитать количество подведенной или отведенной теплоты. 5. Рассчитать уеличину изменения внутренней энергии. 6. Рассчитать величины изменения энтальпии рабочего тела.
- Рассчитать величину изменения энтропии рабочего тела.
Политропными процессами наз. процессы, протекающие при постоянной теплоемкости и вызываемые подводом или отводом теплоты. Следовательно, в любом политропном процессе, распределение теплоты между значениями, характеризующими изменение внутренней энергии и работу газа, остается неизменным, т.е. отношение:
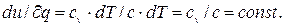
где с – постоянная для данного газа теплоемкость газа или
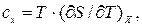 т.е.
т.е. 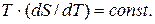
Для вывода уравнения обратимого политропного процесса идеального газа используем общее уравнение 1-го закона ТТД:
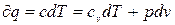 , (4.1) или
, (4.1) или 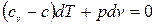 , (4.2)
, (4.2)
Воспользуемся характеристическим уравнением состояния газа (pv=RT), продифференцировав которое получим: рd v + v dp=RdT, т.е. dT=(pd v + v dp)/R
Решив совместно уравнения (4.1) и (4.2), получим: 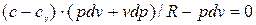
раскрыв скобки, получим: 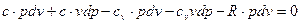
Сгруппировав слагаемые, содержащие произведения v dp и pd v, а также учитывая, что  , после преобразований будем иметь:
, после преобразований будем иметь: 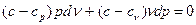
Разделив это равенство на (c-cv), получим: 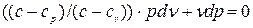
Обозначив через n дробь 
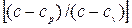 получим: n pd v + v dp=0
получим: n pd v + v dp=0
Разделив это равенство на pv, после интегрирования и последующего потенцирования,
получим: 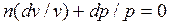 ;
; 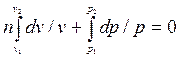 ;
; 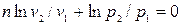
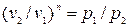 ;
; 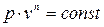 , (4.3)
, (4.3)
Уравнение (4.3) носит название уравнения политропного процесса,
где: 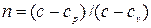 - показатель политропы.
- показатель политропы.
Показатель политропы может принимать любое численное значение в пределах от 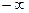 до
до 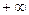 , но для данного процесса он явл. величиной постоянной.
, но для данного процесса он явл. величиной постоянной.
Связь между параметрами p, v, T, а именно:
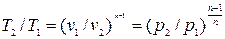 , (4.4)
, (4.4) 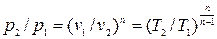 , (4.5)
, (4.5)
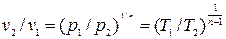 , (4.6)
, (4.6)
Работа политропного процесса.
Поскольку работа изменения объема газа в любом процессе выражается уравнением 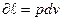 , то для политропного процесса в соответствии с уравнениями политропы, имеем:
, то для политропного процесса в соответствии с уравнениями политропы, имеем: 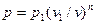 , следовательно:
, следовательно:
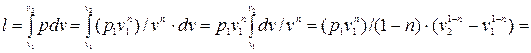 (4.7)
(4.7)
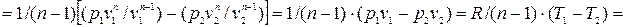
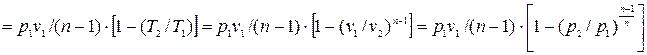 Количество теплоты, подводимой к системе (или отводимой от нее) в политропном процессе, определяется следующим образом:
Количество теплоты, подводимой к системе (или отводимой от нее) в политропном процессе, определяется следующим образом:
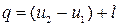 т.к.
т.к. 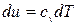 , и
, и 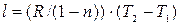 то получаем:
то получаем:
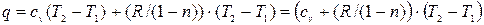
но 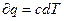 т.е. q=c (T2-T1) и следовательно
т.е. q=c (T2-T1) и следовательно
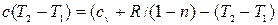 после преобразований (учитывая, что
после преобразований (учитывая, что 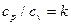 ), имеем:
), имеем: 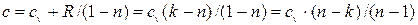
Откуда:
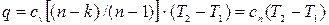 (4.8)
(4.8)
где 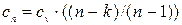 - теплоемкость идеального газа в политропном процессе.
- теплоемкость идеального газа в политропном процессе.
При сv, k, n=const поэтому и сn=const, т.е. политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение внутренней энергии равно: 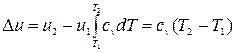 , (4.9)
, (4.9)
Изменение энтальпии равно: 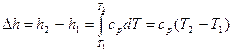 , (4.10)
, (4.10)
Изменение энтропии в политропном процессе:
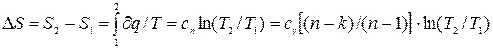 , (4.11)
, (4.11)
При движении газа в потоке располагаемая работа его в политропном процессе равна:
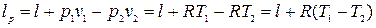 (4.12)
(4.12)
|
|
Дата добавления: 2014-11-29; Просмотров: 1841; Нарушение авторских прав?; Мы поможем в написании вашей работы!