
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шымкент, 2014 3 страница
|
|
|
|
Шешуі: Таблетканың беттік қабатындағы қышқылдың концен-трациясы (СS) мен ерітіндідегі (С) қарастырылып отырған уақыт ішінде өзгермей тұрақты болатындықтан, қышқылдың беттік қабат арқылы диффузиясын стационарлы диффузия деп есептесек:
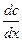 =
= 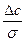 =
= 
Стационарлы ағын үшін жоғарыдағы теңдеу мына түрде жазылады:
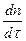 =
=  =
= 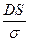 ∙ (СS – С)
∙ (СS – С)
Жылдамдық константасы k = 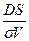 , оны табу үшін DS/σ- ны есептейміз:
, оны табу үшін DS/σ- ны есептейміз:
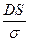 =
= 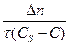 =
= 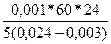 = 13714 см2/тәуелік.
= 13714 см2/тәуелік.
Сонда
k= 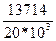 = 0,6857 тәул-1; β=
= 0,6857 тәул-1; β=  =
= 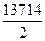 = 6857см/тәул.
= 6857см/тәул.
σ =  =
= 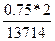 = 1,09∙10-4см.
= 1,09∙10-4см.
№8 лекция. Катализаторлардың белсенділігі
Активті комплекс теориясы бойынша химиялық реакция түсетін заттардың молекулалары бір-бірімен активті соқтығысқаннан кейін олар реакция өніміне бірден айналмай алдымен аралық комплекс түзеді. Түзілген аралық комплекс энергиясы жоғары тұрақсыз бөлшек болуы нәтижесінде тез арада реакция өніміне айналады.
Реакция жылдамдығы активті коплекстің қасиеттерімен анық-талады. Жылдамдық константасының теңдеу аралық активті ком-плекс және реакцияласатын заттардың статистикалық күй жиын-тықтары аралығы теңдеуін жазсақ:
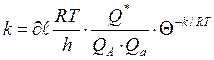 (54)
(54)
Мұндағы:
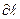 – трансмиссиялық коэффициент (әдетте
– трансмиссиялық коэффициент (әдетте  );
);
К– Больцман тұрақтысы;
Т– абсолюттік температура;
һ – Планк тұрақтысы;
Q∙– активті комплекстің күй жиынтығы;
QА,Qа – реакцияласатын заттардың күй жиынтықтары;
Е – активтену энергиясы;
R – уневерсал газ тұрақтысы.
Жылдамдық константасының активті комплекс түзілу сатысының тепе-теңдік константасымен байланысы:
|
|
|
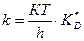 (55)
(55)
Мұнда стандартты күй ретінде концентрацияның Імоль/см3 немесе Імоль/л мәні алынады. Егер стандартты күй ретінде қысым-ның Іатм мәні алынса, онда
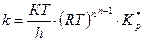 (56)
(56)
Мұндағы:
n –активті комплекс түзуге қатысқан молекулалар саны.
Бұл теңдеуді активті комплекс түзілу реакциясының термодина-микалық теңдеуі арқылы жазсақ:
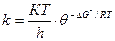 (57)
(57)
осыдан



немесе
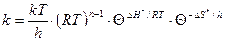

 (58)
(58)
Мұндағы:
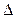 G∙,
G∙, 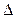 Н∙ және
Н∙ және 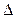 S∙ - активтену процесінің Гиббс энергиясы, энергиясы энтальпиясы және энтропиясы.
S∙ - активтену процесінің Гиббс энергиясы, энергиясы энтальпиясы және энтропиясы.
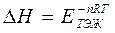 екені белгілі, осыдан
екені белгілі, осыдан

 немесе
немесе
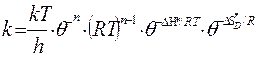 (59)
(59)
Бұл теңдеулерді Аррениустың теңдеуімен салыстырсақ, экспо-нента көбейткіші (С) активтену энергиясымен байланысты екенін көреміз:
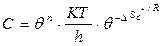 немесе
немесе
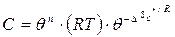 (60)
(60)
№9 лекция. Катализатордың белсенділік энергиясы. Аррениус теңдеуі
Активтендіру теориясы бойынша температураны арттырғанда
системада актив молекулалардың үлесі артады. Ол өз кезінде реакция жылдамдығының артуына әкеп соғады. Демек, температураны арттырғанда актив емес молекулалар қосымша энергия қабылдап, активті күйге келеді.
Әрекеттесуші заттардың молекулаларын активті күйге келтіру үшін қажетті энергиясы активтендіру энергиясы деп атайды. Осы актив молекулалар өзара соқтығысып, реакцияға түседі. Системадағы актив молекулалардың үлесі мына формуламен анықталады:
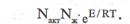
Мұндағы: Е- активтендіру энергаясы, Дж/моль,
R-универсалды газ тұрақгысы, Дж/моль, е-натурал логарифм негізі.
Химиялық реакцияның "К"-мен температура арасындағы тәуелділікті Аррениус теңдеуімен анықгауға болады:

Мұндағы А-тұрақты шама. Бұл теңдеудегі "Е" екі жолмен анықгауға болады.

|
|
|
|
І.Екі температурадағы жылдамдықконстанталары бойынша
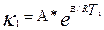 және
және 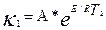
Осы екі теңдеуді өзара біріктіріп шешетін болсақ, онда:

Ордината өсі бойымен 1 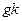 мәнін, абсцисса өсі бойымен температураның кері мәнімен алатын болсақ, онда алынған түзу сызықтық абсцисса өсімен қиылысу бұрышының тангенсі.
мәнін, абсцисса өсі бойымен температураның кері мәнімен алатын болсақ, онда алынған түзу сызықтық абсцисса өсімен қиылысу бұрышының тангенсі.
- 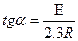 - шамасын, ал ордината өсімен қиылысу нүктесімен
- шамасын, ал ордината өсімен қиылысу нүктесімен
координаталар басталатын нүкте аралығы "lgА" береді. (Олардан "Е" және "А" табу қиын емес). (1-сурет).

Қарапайым реакциялар үшін мономолекулярлы реакциялар-бірінші ретті, бимолекулярлы-екінші ретті болады. Ал күрделі реакциялардың молекулярлығы мен реті сәйкес келе бермейді.
Химиялық реакция ретін анықтау үшін жылдамдықтың концентрацияға тәуелділігін керсететін теңдеуді, жартылай мерзімін немесе графиктік әдісті қолданады.
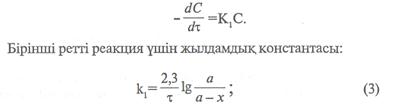
|
Мұндағы «а» -заттың алғашқы мөлшері, моль/л, х – уақыттың ішінде заттың реакцияға түскен мөлшері, моль/л. (а-х)-уақыттағы заттың реакцияға түспей қалған мөлшері, моль/л. Екінші ретті реакциялар үшін кинетикалық тендеу формуласы:

Мұңдағы 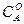 және
және 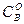 "А" және "В" заттарының бастапқы концентрациялары. Егер "
"А" және "В" заттарының бастапқы концентрациялары. Егер " 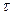 " уақыттан кейінгі Ажәне В заттарының концентрациясын (а-х) жене (b-х) десек, оңда (4) теңдеуді былай жазады:
" уақыттан кейінгі Ажәне В заттарының концентрациясын (а-х) жене (b-х) десек, оңда (4) теңдеуді былай жазады:
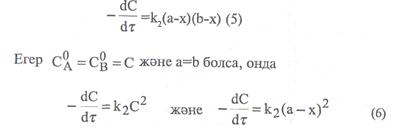
Егерде (5) және (6) теңдеулерді интегралдап, екінші ретті реакциялардың кинетикалық теңдеуін төменгі түрге келтіреміз:
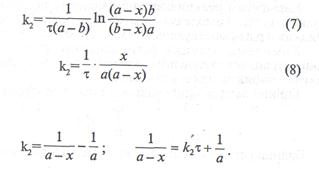
Екінші ретті реакцияның жартылай өту уақыты заттардың бастапқы концентрациясына кері пропорционал екенін көреміз.
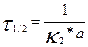 (9)
(9)
№10 лекция. Катализдің өндірісте қолданылуы.
1) Өнекәсіптік катализаторлар көп компонентті, кейде көп фазалы болады. Күрделі катализаторды келесі әдістермен алады:
1. Катализатор активтілігін арттыратын промоторлар қосу арқылы(қосымша зат) промоторлар аз мөлшерде 0,1-5 % дейін қосылады. Бірақ активтілікті көп арттырады. Бұлардың әсерінің механизмі әртүрлі. Мысалы, жартылай өткіз-рде промотор жаңа энергетикалық деңгейлер түзеді. Кейбір промоторлар катализаторлардың кристалдық торын өзгертеді.
|
|
|
2. Бірнеше компонентті аралыстырып жаңа қосылыс немесе қатты ерітінді немесе көп фазалы жүйе түзу арқылы. Мысалы, аралас катализаторлар Ғе- Cr-K араласт немесе CuO-ZnO-Al2 O3 механикалық араластыру арқылы. Көп фазалы катализаторға мысал: Pt/γ –Al2 O 3 немесе Pt/ η- Al2 O 3,
3. Тасымалдағыш қолдану арқылы бұның нәтижесі а) кt-рдың бағасы төмен; б) тасымалдағыштың арқасында активті компоненттің беті тұрақтанады. Тасымалдағыш инертті т-ш жоқ қоспалар. Сондықтан мұндай kt-рды көп фазалы kt-рдан ажырату қиын.
4. kt-рды модификациялау арқылы.2 түрлі мод-р болады.: а) фазалық модификациялар kt-рдың активті фазасын тұрақтандырады Мыс, Сr2 O3 қоссақ металдар СuO→Cu kt-рдың мысқа шейін т-с нуын тежейді. б) құрылымдық модефикациялар kt-рдың қолайлы құрылымын тұрақтандырады. Мысалы. Ғе катализатор 1 %, Al2 O 3 қоссақ, онда Ғе-ң беті 0,5-10 м2 дейін артады және жоғары температура әсерінен бет кішіреймейді.
5. Kt- дік жүйелерді түзу арқылы әртүрлі kt-рды араластырыру арқылы алынады. Мысалы, Al2 O 3 -пен силикогельдің механикалық қоспасы этилен оксидінің изомерлену реак-да жоғары активтілік көрсетеді, ал жеке-жеке бұлардың активтілігі төмен болады. Мысалы. Перидиндердің су буының әсерінен деалкилденуі.
Қоңыр қышқылын алу. Пробиркаға жаңа даярланған бензой альдегидінен 0,5 мл, сірке ангидридіден 0,5 г, сусыз натрий ацетатынан 0,3 г салып, су жылытқышта бір екі сағат бензой альдегидінің иісі жойылғанша қыздырады да оған аздап тұз қышқылын қосады. Пайда болған қоспаны тез суытады. Сол кезде қоңыр қышқылдың түссіз кристалдары тұнбаға түсе бастайды
Бензой қышқылының этил эфирін алу. Прбиркаға 1г бензой қышқылын салып оған 2 мл этил спиртін және 0,5 млконцентрациялы күкірт қышқылы мен 5 мл су қосады. Қоспа бетінде бензой қышқыл зтил эфирінің өзіне тән иісі бар майлы қабаты түзіледі:
|
|
|


 O
O
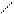


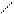
 C6H5- COOH + CH3 – CH2OH
C6H5- COOH + CH3 – CH2OH 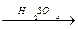 C6H5- C
C6H5- C
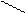 O- C2H5 + H2O
O- C2H5 + H2O
Бензой қышқылының айдалуы. 0,5 г бензой қышқылын құрғақ пробиркаға салып қыздырса, бензой қышқылы айдалады да, пробирканың суық қабырғасында қайтадан кристалданады
Хлорлы бензоил алу (тартпа шкафта). 0,5 г ұнтақталған фосфор (V) хлоридін құрғақ пробиркаға салып оның үстіне араластыра отырып 0,5 г бензой қышқылын қосады. Алғышқы кезде көп мөлшерде хлор сутек бөлінеді де қоспа қатты қызып, сұйыла бастайды. Алынған ерітіндіні суытып басқа пробиркаға аздап бөліп алып, оған 2-3 мл суық су қосса өзіне тән иісі бар, ауыр май тәрәзді сұйық зат хлорлы бензойл бөлініп шығады.
Бензоамид алу. Жоғарғы тәжірибеден қалған хлорлы бензоилге 5 мл концентрациялы аммиак ерітіндісін аз-аздап тамызады да пробирканы мұзды суға батырып, салқындатады. Суыған кезде түссіз бензоамид кристалдары тұнбаға түседі:



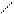 O О
O О


 C6H5- C + NH3 → C6H5- C + HCl
C6H5- C + NH3 → C6H5- C + HCl
 Cl NH2
Cl NH2
Ерітіндіні сүзеді, алынған кристалға 4 мл натрий гидроксидін қосып, қайнағанша қыздырса, аммиак бөлінеді. Қалған затты салқындатқанда, гидролизденуден түзілген түссіз кристалл бензой қышқылы тұнбаға түседі.




 O O
O O

 С6H5-C + H2O → NH3↑ + C6H5 - C
С6H5-C + H2O → NH3↑ + C6H5 - C
NH2 OH
Бензой қышқылын және оның тұзын алу. 2 мл суы бар прбиркаға 5-6 тамшы хлорлы бензойл тамызады, хлорлы бензойл суда ерімейді, пробирканың түбіне шөгеді. Қоспаны шайқай отырып, хлорлы бензойл иісі жойылғанша және судатолық ерігенше қыздырады, соңынан салқындатады. Суыған сайын қоспа түбіне бензой қышқылының кристалдары шөге бастайды. Кристалдарды бөліп алып натрий гидроксиді ерітіндісін қосса, кристалдар еріп кетеді.



 O O
O O







 C6H5-C + H OH → HCl + C6H5-C
C6H5-C + H OH → HCl + C6H5-C

 Cl OH
Cl OH

 O
O
C6H5-C + NaOH→ C6H5COONa + H2O
 OH
OH
Фенолфталеин алу. 0,1 г фталь ангидриді бар пробиркаға сондай мөлшерде фенол қосып, оның үстіне2-3 тамшы конц. Күкірт қышқылын тамызады. Қоспаны ұзақ уақыт қыздырып, суытады. Сонан соң 2-3 мл этил спиртінде біраз ерітіп, алынған ерітіндіден натрий гидроксиді құйылған пробиркаға тамызады. Сілтінің түсі қызырады. Қызарған ерітіндіге аздап күкірт қышқылын тамызса, ерітінді қайтадан түссіз қалыпқа айналады:
№11 лекция. Гидрлеу.
- Гидрогендеу процестерінің теориялық негіздері
- Гидротазалау
2.1 Гидротазалау процестерінің кинетикасы
2.2 Гидротазалау процестерінің катализаторлары
3. Гидрокрекинг
3.1 Гидрокрекинг катализаторлары
4. Гидрокрекинг жағдайларындағы көмірсутектер айналуларының химизмі
1. Гидрогендеу процестерді мұнай өндеуінде және мұнай химиясында кеңінен пайдаланады. Гидрогендеу процестерді жағармайлардың, дизельді және қазандық отындардың сапасын жақсарту, сонымен қатар жоғарыоктанды бензиндерді алу үшін қолданады. Бұл процестердің негізгі арнауы – өнделген мұнай фракцияларының құрамын реттеу, отындар, майлар және мұнайхимия шикізаттың пайдалану сипаттамаларын жақсарту мақсатында құрамындағы күкіртті және азотты қосылыстарды кетіру.
Гидрогендеу процестері негізгі екі бағытта дамып келеді:
- Молекулалық массасы төмен өнімдер алу мақсатында мұнай шикізатын үздіксіз деструктивті ыдыратып өндеу (гидрокрекинг);
- Әр түрлі мұнай фракцияларын қанықпаған және күкіртті қосылыстардан тазалау (гидротазалау).
Гидрокрекинг және гидротазалау – катализдік процестер. Каталитикалық гидрогендеу деп мұнай өнімдерін каталитикалық жолмен сутектендіру құбылысын айтады. Гидрогендік процестердің катализаторлары ретінде никель, кобальт, молибден, вольфрам сияқты металдардың оксидтері және сульфидтері, қышқылдық тасымалдаушыда – алюмосиликаттарда, алюминий оксидінде және т.б. қолданылады.
2. Мұнай өнімдерді гидротазалау немесе катализдік асылдату – МӨЗдарда өте маңызды. Гидротазалау процесті түрлі мұнай фракцияларын гетероатомды қосылыстардан тазалау мақсатында қолданады. Гидротазалау кезінде бір мезгілде тұрақсыз шектеусіз көмірсутектердің гидрлену арқылы сәйкес шектелген қосылыстар түзіледі. Гидротазалауды гидрлеуші катализаторларда жүргізеді. Гидротазалау катализаторларына қойылатын негізгі талап – каталитикалық уларға, әсіресе күкіртті қосылыстарға тұрақты болуы. Процестің тиімділігі катализатордың активтілігіне тәуелді. Гидротазалау процестің негізінде гетероатомды қосылыстардың экзотермиялық гидрлену реакциялар жатады. Бұл реакциялар нәтижесінде сутегісіз заттар бөлінеді:
RSR + 2H2 → 2RH + H2S ↑
RNHR + 2H2 →2RH +NH3↑
Кәдімгі жағдайда күкіртсутек газ тәрізді зат, мұнайөнімді қыздырғанда бөлініп шығады. Суармалау колонналарда түзілетін күкіртсутекті сіңіртеді, соңынан одан элементті күкіртті немесе концентрлі күкірт қышқылын алады.
Жалпы, мұнайды күкіртқұрылымды қосылыстардан тазалау әдістерді екі топқа бөлуге болады: күкірторганикалық қосылыстарды ыдыратып отындардан шығарып тастау тәсілдері; бір мезгілді күкірттің органикалық қосылыстарын таңдамалы бөліп алу және мұнай фракцияларын тазалау әдістері.
Гидрогенолиз күкірттің барлық органикалық қосылыстардың топтарына сипатты реакция:
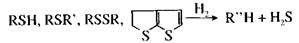
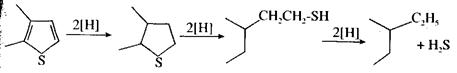
Тұрақтылықтарына сәйкес келетін КОҚның гидрлену жылдамдығы мына ретте артады: меркаптандар > дисульфидтер > сульфидтер = тиофандар > тиофендер.
Гидрогенолиз жағдайларын өзгеруі – сутегі қысымының жоғарлануы, катализатордың активтілігі өсуі, температураның өзгеруі – КОҚдың гидрлену процесіне белсенді әсер етеді. Гидротазалаудан түзілген күкіртсутегі одан әрі элементті күкірт және күкіртті қышқыл алуға қолданылады.
2.1 Гидротазарту процестерінің кинетикасы. Ауыр өнімдерді гидротазартуда процесстің кинетикасына диффузиялық шектеулер әсер етеді. Гидротазартудың жылдамдығын есептеу үшін бірінші ретті теңдеуін қолданады:
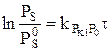 ,
,
Мұндағы PS и PS° – гидрогенизаттағы және шикізаттағы күкіртті қосылыстардың парциалды қысымы; 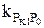 - берілген температурада, сутектін парциалды қысымында жылдымдық константасы; τ – контактнің шартты уақыты
- берілген температурада, сутектін парциалды қысымында жылдымдық константасы; τ – контактнің шартты уақыты
Өндірістік шикізат үшін:
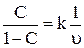 ,
,
Мұндағы С – өнімдегі күкірттін мөлшерінің өнімдегі күкірттің мөлшеріне проценттік қатынасы; k – реакцияның жылдамдық константасы; υ – көлемдік жылдамдық.
2.2. Гидротазарту процестерінің катализаторлары. Гидротазарту үшін VII және VIII топ металдар (никель, кобальт, молибден, вольфрам) оксидтері негізінде катализаторларды қолданады. Өнеркәсіпте алюмокобальтомолибдендік (АКМ) және алюмоникельмолибдендік (АНМ) катализаторларды қолданады. Силикат негізіндегі алюмоникельмолибдендік катализаторға беріктікті күшейті мақсатында кремний диоксидін енгізеді (АНМС). Тасымалдағыш болып алюминий оксиді табылады.
3. Гидрокрекинг – ол жарқын түсті мұнай өнімдерін (жанармайды, керосинді, дизель отынын) алу үшін, сонымен қатар С3 – С4 қойытылған газдарды мұнай шикізатының, молекулярлық массасынан жоғарырақ болатын, мұнай шикізатын сутегінен өңдеуде қысым арқылы алу үшін қолданылатын катализдік процесс. Гидрокрекинг мұнай өнімдерінің кең түрдегі ассортиментін алуға мүмкіндік жасайды – тәжірибеде қандай да болмасын мұнай шикізатынан, тиісті катализаторларды және шарттарды таңдай алу арқылы және мұнай өңдеудің ең бір тиімді және икемді процесі болып табылады.
3.1 Гидрокрекинг катализаторлары
Катализаторлар әдетте келесі компоненттерден тұрады: қышқылдық, гидрлеу және байланыстурышы. Қышқылдық компонент ретінде цеолиттер, алюминий оксидтері, алюмосиликаттар пайдаланылады. Гидрлеу компоненті болып әдетте Pt, Pd, Ni, Co, Fe сияқты металдар, сонымен қатар кейбір металдардың Mo, W оксидтері немесе сульфидтері қызмет атқарады. Белсенділікті көтеру үшін пайдалану алдында сутегімен қалпына келтіреді, ал оксидтік молибден және құрамында вольфрамы бар катализаторлар – сульфиттеленеді.Сонымен қатар катализаторды белсендіру үшін әртүрлі промоторларды пайдаланады. Промоторлар ретінде ең белгілі болып рений, родий, иридий және кобальт мен никель оксидтері саналады. Байланыстырушы қызметін қышқылдық компонент, сонымен қатар кремний, титан, цирконий, магний және цирконий силикаттары атқарады.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 1516; Нарушение авторских прав?; Мы поможем в написании вашей работы!