
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика подгруппы кислорода
|
|
|
|
Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
Хлорная известь. Получение, свойства, применение.
Хлорная вода. Получение, свойства, применение.
Получение: 
Химические свойства: 
Применение: Используется для обеззараживания воды в бассейнах способом хлорирования, очень слабый раствор хлора в питьевой воде обеспечивает ее обеззараживания без нанесения большого ущерба здоровью.
Получение: 
Получают взаимодействием хлора с гашеной известью (гидроксидом кальция).
Химические свойства:
На воздухе хлорная известь медленно разлагается по схеме:
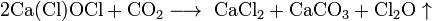 .
.
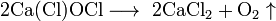 , термическое разложение
, термическое разложение
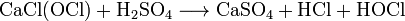
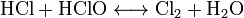
Применение: Широко используется для отбеливания и дезинфекции.
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделлева.

Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R: H2О, H2S, H2Sе, H2Те – хальководороды.
8. Вода. Физические и химические свойства. Вода как растворитель. Биологическая роль воды.
Физические свойства: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
|
|
|
Химические свойства: вода незначительно диссоциирует:

В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:

Взаимодействует со многими основными оксидами, металлами:
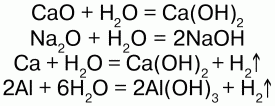
С кислотными оксидами:
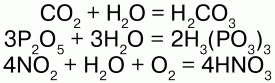
Вода - превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Биологическая роль воды:
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.












|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1116; Нарушение авторских прав?; Мы поможем в написании вашей работы!