
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ю.И. Категоренко 1 страница
|
|
|
|
ОГЛАВЛЕНИЕ
Введение…………………………………………………………………………..
РАЗДЕЛ 1. СТРОЕНИЕ И СВОЙСТВА ЖИДКИХ МЕТАЛЛОВ И СПЛАВОВ
Глава 1.1. Современные представления о природе и строении твердых и жидких
металлов и сплавов…………………………………………………………………………..
1.1.1. Природа и строение твердых металлов и сплавов ………………………………………
1.1.2. Современные представления о механизме плавления ………………………………..
1.1.3. Модели жидкого состояния ……………………………………………………………
1.1.4. Математические и экспериментальные методы исследования жидкого состояния …..
1.1.5. Особенности строения жидких сплавов ………………………………………………
1.1.6. Взаимосвязь жидкого и твердого состоянии сплава ………………………………….
Глава 1.2. Реологические свойства жидких и твердых сплавов ………………………………
1.2.1. Простейшие реологические модели тел ……………………………………………….
1.2.2. Вязкость перегретых жидких сплавов …………………………………………………..
1.2.3. Реологические свойства сплава в интервале кристаллизации………………………….
Глава 1.3. Поверхностные явления в металлах и сплавах …………………………………….
1.3.1. Поверхностное натяжение жидких металлов ………………………………………….
1.3.2. Поверхностное натяжение сплавов …………………………………………………….
1.3.3. Капиллярные явления. Смачиваемость …………………………………………………
1.3.4. Силы адгезии и когезии…………………………………………………………………
1.3.5. Роль поверхностных явлений в пригарообразовании на отливках…………………..
Контрольные вопросы и упражнения ………………………………………………………..
РАЗДЕЛ 2. ОСНОВЫ ТЕОРИИ ФОРМИРОВАНИЯ КРИСТАЛЛИЧЕСКОЙ
Глава 2.1. Основные закономерности самопроизвольной кристаллизации
|
|
|
металлов и сплавов…………………………………………………………………………………
Глава 2.2. Теория гетерогенного зародышеобразования …………………………………….
Глава 2.3. Механизм и кинетика роста кристаллических зародышей……………………….
Глава 2.4. Кинетика кристаллизации. Формула Колмогорова……………………………….
Глава 2.5. Перераспределение примесей на фронте кристаллизации сплавов.
Внутрикристаллическая ликвация …………………………………………………………………
Глава 2.6. Концентрационное переохлаждение. Условие устойчивости
плоского фронта кристаллизации сплавов ……………………………………………………….
Глава 2.7. Ячеистая и дендритная кристаллизация ……………………………………………
Глава 2.8. Особенности кристаллизации эвтектики ………………………………………….
Глава 2.9. Кристаллическая структура отливок ……………………………………………….
2.9.1. Структурные зоны в отливке ……………………………………………………………
2.9.2. Химическая неоднородность сплава в отливках ………………………………………..
Глава 2.10. Методы управления кристаллическим строением отливки……………………….
2.10.1. Влияние теплового режима плавки, заливки и затвердевания
сплава ………………………………………………………………………………………………..
2.10.2. Модифицирование сплавов …………………………………………………………..
2.10.3. Физико-химические методы управления формированием кристаллической
структуры отливок ………………………………………………………………………………..
Контрольные вопросы и упражнения ………………………………………………………..
РАЗДЕЛ 3. УСАДОЧНЫЕ ЯВЛЕНИЯ ПРИ ФОРМИРОВАНИИ ОТЛИВКИ
Глава 3.1. Физическая природа усадки. Объемная и линейная усадка ……………….
Глава 3.2. Влияние технологических факторов на усадку сплавов в отливках ……………..
Глава 3.3. Объемные усадочные дефекты в отливках.………………………………………
3.3.1. Формирование усадочных раковин ……………………………………………………
3.3.2. Влияние технологических факторов на конфигурацию и положение
|
|
|
усадочной раковины в отливке ……….………………………….………………………………..
3.3.3. Усадочная пористость в отливках …………………………………………………….
3.3.4. Методы борьбы с объемными усадочными дефектами. Расчет и
конструирование прибылей ……………………………………………………………………..
Глава 3.4. Литейные напряжения и деформации в отливках ……………………………….
3.4.1. Горячие трещины в отливках …………………………………………………………
3.4.1.1. Теория горячеломкости сплавов ……………………………………………………
3.4.1.2. Реологическая модель сплава в интервале кристаллизации ……………………….
3.4.1.3. Механизм образования горячих трещин …………………………………………….
3.4.1.4. Мероприятия по борьбе с образованием горячих трещин в отливках…………….
3.4.2. Литейные напряжения в отливках ……………………………………………………
3.4.2.1. Усадочные напряжения в отливках …………………………………………………
3.4.2.2. Термические напряжения в отливках ………………………………………………
3.4.2.3. Фазовые напряжения в отливках ……………………………………………………
3.4.2.4. Пороки отливок, вызываемые литейными напряжениями ………………………..
3.4.2.5. Мероприятия по снятию литейных напряжении …………………………………..
3.4.2.6. Классификация внутренних напряжений ………………………………………….
Контрольные вопросы и упражнения ……………………………………………………..
Литература …………………………………………………………………………………..
Вопросы к экзамену
Раздел 1. СТРОЕНИЕ И СВОЙСТВА ЖИДКИХ МЕТАЛЛОВ И СПЛАВОВ
ГЛАВА 1.1. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ И СТРОЕНИИ ТВЕРДЫХ И ЖИДКИХ МЕТАЛЛОВ И СПЛАВОВ
В зависимости от давления и температуры любое вещество может находиться в твердом, жидком, газообразном состояниях, а также в состоянии плазмы. Диаграмма состояния однокомпонентного вещества приведена на рис. 1.1. Линии АД и АД' на диаграмме разделяют

Рис. 1.1. Диаграмма состояния однокомпонентной системы
области кристаллического состояния и жидкости. Линия АД относится к веществам, удельный объем которых при плавлении увеличивается (большинство веществ), а линия АД' — к воде, галлию, висмуту, сурьме, германию и кремнию, удельный объем которых при плавлении уменьшается. Из диаграммы видно, что с увеличением давления температура плавления этих веществ уменьшается. Температура плавления большинства веществ с ростом давления увеличивается. Следует отметить, что линии АД и АД' представляют собой линии равновесия кристалл — жидкость, т. е. геометрическое место точек, отвечающих значениям параметров (давление Р и температура Т), при которых кристалл и жидкость находятся в динамическом равновесии друг с другом. В этом случае граница раздела твердой и жидкой фаз является плоской. При искривлении поверхности раздела характер зависимости температуры плавления остается таким же, но линии смещаются влево или вправо в зависимости от того, выпуклое или вогнутое твердое тело.
|
|
|
Температура плавления выпуклых кристаллов (сферических частиц) меньше, чем плоских, а температура плавления вогнутых кристаллов (включения металла в различных неметаллических частицах) выше, чем плоских. Связь температуры плавления кристаллов с их радиусом кривизны и температурой плавления плоских кристаллов Травн, которую будем называть равновесной, выражается следующей формулой:
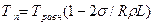 , (1.1)
, (1.1)
где а — коэффициент межфазного натяжения кристалла на границе с жидкостью; R — радиус кривизны кристалла и L — удельная теплота плавления. В формуле радиус кривизны выпуклого кристалла положительный, а вогнутого — отрицательный. Из формулы видно, что для плоского кристалла (R = ∞) Тп = Травн, с уменьшением радиуса кривизны температура плавления выпуклого кристалла уменьшается, а вогнутого — увеличивается.
Формула (1.1) написана для кристаллов, ограниченных сферической поверхностью. При произвольной конфигурации поверхности формула имеет вид
 , (1.2)
, (1.2)
где R1 и R2 — главные (наибольший и наименьший) радиусы кривизны поверхности. Следует отметить, что изменения температуры плавления становятся существенными лишь при радиусах поверхностей кристаллов, меньших 0,001 мм.
Линия АВ является линией равновесия жидкости и пара. Для каждого значения температуры в пределах от Т до Ткр по линии АВ мы можем найти давление насыщенного пара жидкости. Точка В отвечает критическому состоянию (точка абсолютного кипения), при котором исчезает различие между жидким и газообразным состояниями вещества. При температуре выше Ткр газ невозможно перевести в жидкость ни при каких давлениях. При атмосферном давлении ширина области жидкого состояния (между линиями АД и АВ) для многих металлов достаточно велика и значительно превышает применяемые в практике литья перегревы металла выше его температуры плавления. Например, температура плавления (Тп) алюминия — 660°С, а температура кипения (Ткип) — 2327°С; для меди Тп = 1083°С, Ткип = 2596°С; для железа Тп = 15Зб0С, Tки п = 2 880°С. Для этих металлов испарение в условиях литейных процессов не играет большой роли. В то же время для цинка Тп = 419,5°С, Ткип = 906°С; для магния Тп = 651°С, Ткип = 1 107°С. Для этих металлов температура кипения близка к температуре плавления. Они отличаются, как говорят, большой летучестью. Поэтому при их наличии в сплавах необходимо учитывать процессы парообразования.
|
|
|
При температурах, значительно превышающих Ткр, происходит ионизация газов и они переходят в состояние плазмы, представляющей собой совокупность ионов и электронов.
Как видно из диаграммы, жидкое состояние вещества занимает промежуточное место между твердым и газообразным состояниями. Поэтому жидкости сохраняют отдельные свойства как твердых, так и газообразных тел. Твердые тела по характеру расположения и движения атомов и молекул подразделяются на кристаллические и аморфные.
1.1.1. ПРИРОДА И СТРОЕНИЕ ТВЕРДЫХ МЕТАЛЛОВ И СПЛАВОВ
Основным свойством кристаллического состояния вещества является правильное, упорядоченное расположение атомов в пространстве. Кристаллическое состояние вещества характеризуется четкой пространственной структурой, называемой кристаллической решеткой.
О. Браве установил, что любой кристалл можно построить на основе 14 элементарных ячеек. Наиболее распространенными ячейками металлических кристаллов являются кубическая объемно центрированная (ОЦК), кубическая гранецентрированная (ГЦК), компактная гексагональная (рис. 1.2). Предполагается, что в идеальном кристалле атомы расположены строго в узлах решетки и неподвижны. Кроме того, считается, что решетка является бесконечно протяженной, т. е. каждая элементарная ячейка окружена достаточным количеством других ячеек (далека от поверхностей реальных тел).
Важнейшей характеристикой кристаллической решетки является координационное число, т. е. число ближайших соседей данного атома. С помощью элементарных геометрических расчетов можно определить, что в объемно центрированной кубической решетке координационное число — 8, т. е. около каждого атома в решетке находится 8 атомов, расположенных на минимальном расстоянии r1 = а  , где а — параметр решетки. На расстоянии r2, равном а, находится 6 атомов, и на расстоянии r4 = а
, где а — параметр решетки. На расстоянии r2, равном а, находится 6 атомов, и на расстоянии r4 = а 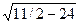 атома. Расположение атомов в решетке дискретно, так как они находятся лишь на определенных расстояниях от данного атома, называемых радиусами координационных сфер. Таким образом, в объемно центрированной кубической решетке на первой координационной сфере с r1 = а
атома. Расположение атомов в решетке дискретно, так как они находятся лишь на определенных расстояниях от данного атома, называемых радиусами координационных сфер. Таким образом, в объемно центрированной кубической решетке на первой координационной сфере с r1 = а  , находится 8 атомов, на второй с r2 = а — 6 атомов, на четвертой с r4 = а
, находится 8 атомов, на второй с r2 = а — 6 атомов, на четвертой с r4 = а 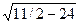 и т. д. Между сферами атомов нет.
и т. д. Между сферами атомов нет.

Рис. 1.2. Распространенные типы кристаллических решеток металлов и сплавов:
а — объемно центрированная; б — гранецентрированная; в — компактная гексагональная.
Для гранецентрированной кубической решетки легко установить, что на первой координационной сфере с r1 = а  находится 12 атомов, на второй с r2 = a — 6 атомов, на третьей с r3 = а
находится 12 атомов, на второй с r2 = a — 6 атомов, на третьей с r3 = а 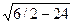 атома и т. д.
атома и т. д.
Приняв в идеальном приближении, что кристалл плотно упакован и соседние атомы касаются друг друга, можно радиус первой сферы принять равным 2R, где R — атомный радиус. С учетом этого получаем, что для объемно центрированного куба r1 = 2R, r2 = 4R  , r4 = 2R
, r4 = 2R 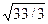 , а для гранецентрированного куба r1 = 2R, r2 = 2R
, а для гранецентрированного куба r1 = 2R, r2 = 2R  , r3 = 2R
, r3 = 2R  и r4 = 4R.
и r4 = 4R.
С учетом полученных значений радиусов координационных сфер и числа находящихся на них атомов можно построить графики пространственного расположения атомов в объемно центрированной и гранецентрированной кубических решетках (рис. 1.3).
Такова в общих чертах характеристика идеального кристалла. Реальный кристалл имеет целый ряд существенных особенностей. Прежде всего, атомы не находятся неподвижно в узлах решетки, а их атомные диаметры не совпадают с радиусом первой координационной сферы.


Рис. 1.3. Распределение числа атомов по первым координационным сферам для
объемно центрированного (а) и гранецентрированного (б) куба.
Известно, что атомы совершают колебания относительно узлов решетки, которые являются положениями равновесия. Интенсивность колебаний, или теплового движения атомов, увеличивается с ростом температуры. При низких температурах атомы совершают колебания относительно фиксированных узлов, т. е. так называемое трансляционное движение отсутствует и атомы не перемещаются поступательно по решетке. Однако с увеличением температуры вероятность появления трансляционного поступательного движения атомов увеличивается. Для того чтобы охарактеризовать механику реального кристалла, рассмотрим вопрос о межчастичном взаимодействии в кристаллах.
Как известно, атомы металлов, как и других элементов, представляют собой положительные ядра с вращающимися относительно них электронами, обладающими разными энергиями (находящимися на разных энергетических уровнях). При сближении любых двух атомов, начиная с некоторого расстояния, их электронные оболочки перекрываются (речь идет о внешних оболочках), подобно тому как при образовании молекулы водорода электроны каждого атома попадают в сферу влияния ядер обоих атомов и обобществляются, т. е. процесс сближения атомов металла приводит к обобществлению части их электронов. В пределах кристаллической решетки эти электроны уже не принадлежат только своим атомам. В результате образуется система, в которой в узлах решетки находятся положительно заряженные ионные остовы, а в объеме решетки расположены свободные коллективизированные электроны. Именно наличием этих электронов объясняется высокая электропроводность металлов.
Рассмотрим процесс сближения атомов. Если расстояние между ними достаточно велико, то атомы можно представить как два диполя, которые притягиваются друг к другу. При этом заряды ближайших атомов обоих диполей вследствие электростатической индукции имеют разную полярность. Это явление, как известно из физики, называется поляризацией. Силы притяжения, возникающие вследствие поляризации, обратно пропорциональны расстоянию между атомами в седьмой степени (Fпр ~ 1/R7). Эти силы называются силами Ван-дер-Ваальса. Такая зависимость сил притяжения говорит о том, что они при увеличении расстояния между атомами быстро убывают (на расстоянии, в несколько раз превышающем размеры атомов, эти силы практически исчезают).
Если атомы сблизить на расстояние, сравнимое с размерами электронных орбит, например несколько меньшее диаметра этих орбит, то электронные оболочки начинают деформироваться и между атомами возникают силы отталкивания, называемые обменными силами. Силы отталкивания близкодействующие, они убывают с увеличением расстояния быстрее, чем силы притяжения. Известно эмпирическое приближение, что Fот ~ 1/R13. Простейшей и широко применяемой формулой для описания потенциала межчастичных взаимодействий является потенциал Ленарда — Джонса:
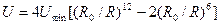 , (1.3)
, (1.3)
где R0 — расстояние, отвечающее минимуму потенциала; Umin — модуль минимума потенциала.
Формула Ленарда — Джонса моделирует изменение потенциала взаимодействия двух частиц. Рассмотрим две частицы, причем левую закрепим неподвижно. Изменение потенциала при изменении расстояния на dR равно работе сил взаимодействия, т. е.
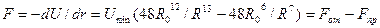 , (1.4)
, (1.4)
где 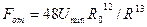 и
и 
Графически изменение результирующей силы взаимодействия и энергии связи частиц с изменением расстояния показано' на рис. 1.4. Видно, что при R = R0 F = 0, т. е. |Fпр| = |Fот|. Положению равновесия отвечает минимум энергии связи, т. е. потенциальная яма. Если бы не было теплового движения атомов, то! атомы в кристаллической решетке располагались бы на расстоянии Ro друг от друга, которое физически определяет параметр решетки.
Отмеченные выше закономерности имеют общий характер. В чем же специфика металлов? Обменные силы отталкивания зависят от степени заполнения внешней электронной оболочки. С ее увеличением силы отталкивания возрастают. Как известно, наибольшую заполненность внешней оболочки имеют инертные газы (гелий, аргон, криптон и т. д.). На внешних оболочках у них максимально возможное число электронов — 8. При сближении атомов оболочки практически не перекрываются и не происходит образование обобщенных электронов и ионов. Поэтому инертные газы — диэлектрики.
Рассмотрим случай, когда внешние электронные оболочки не заполнены электронами (число внешних электронов меньше 8). Здесь возможно большее сближение атомов и перекрытие электронных оболочек с образованием ионов и коллективизированных электронов. Свободные электроны оказывают влияние на силы притяжения. Электроны, находящиеся между двумя положительными ионами, притягивают их с силой, большей силы притяжения ионов, так как расстояние между каждым ионом и электронами меньше, чем расстояние между ионами. При этом всякое изменение параметра решетки вызывает изменение плотности электронов между ионами, что, в свою очередь, приводит к возникновению сил, стремящихся вернуть решетку в исходное состояние. Такой тип связи называется металлическим. Силы отталкивания теперь связаны с деформацией внутренней заполненной электронной оболочки иона, имеющей радиус R2 < R1, где R1 — радиус внешней оболочки, электроны которой коллективизированы. Равновесие ионов достигается на расстоянии R0, находящемся в интервале 2R1 — 2R2.

Рис. 1.4. Зависимость силы (а) и потенциала взаимодействия (б) двух атомов от расстояния между ними.
Металлические чистые кристаллы очень устойчивы по отношению к сильным смещениям частиц. Если металл растянуть, то увеличится вероятность нахождения электронов между ионами (электронная плотность) и появятся силы, стремящиеся вернуть решетку в исходное состояние. Если металл сжать, то электроны вытесняются из межионного пространства, электронная плотность падает и силы отталкивания начинают превышать силы притяжения. При снятии внешнего воздействия решетка вернется в исходное состояние. Поэтому чистые металлы способны без разрушения выдерживать большие пластические деформации. Хрупкость отдельных металлов и сплавов объясняется наличием в решетке различных кристаллических дефектов (вакансии, дислокации и т. п.).
Электроны оказывают существенное влияние на свойства металлов. Однако более детальное рассмотрение электронной теории металлов выходит за рамки данного курса. Интересующимся можно рекомендовать книгу Н. Б. Брандта, С. М. Чудинова «Электронная структура металлов» (М.: Изд-во Моск. ун-та, 1973. 332 с.).
До сих пор мы рассматривали кристалл в условиях, когда кинетическая энергия частиц равна нулю, т. е. частицы неподвижно находятся в положениях равновесия (параметр решетки равен R0) • Однако это невозможно даже при абсолютном нуле. Как и в любом теле, частицы в твердом металле обладают кинетической энергией Е, которая связана с температурой. В первом приближении можно принять, что E = kT, т. е. с ростом температуры Е увеличивается. Если под действием теплового движения положение равновесия нарушится и расстояние между частицами увеличится, то силы притяжения превзойдут силы отталкивания и появится сила, возвращающая частицы в положение равновесия. При уменьшении расстояния между частицами силы отталкивания превзойдут силы притяжения и возвращающая сила снова будет направлена к положению равновесия. Таким образом, возникает ситуация, характерная для колебательного движения. Однако колебания частиц в данном случае будут ангармоническими.
Для возникновения гармонических колебаний необходимо, что бы возвращающая сила была пропорциональна отклонению от положения равновесия. В этом случае кривая энергии связи симметрична (рис. 1.5). Пусть при температуре Т1 энергия теплового движения Е1, а при температуре Т2 > Т1 энергия теплового движения Е2 > Е1. Видно, что частица совершает симметричные колебания, причем с ростом температуры амплитуда колебаний увеличивается. Положение же равновесия при этом не изменяется.
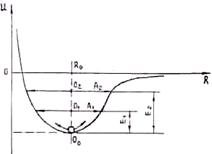
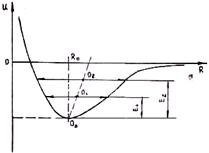
Рис. 1.5. Зависимость потенциала взаимодей- Рис. 1.6. Изменение параметра кристаллической
ствия частиц от расстояния между ними при решётки при нагревании
гармоническом характере колебаний
В кристаллах же возвращающая сила, как видно из формулы (1.4), не пропорциональна отклонению от положения равновесия (R — в знаменателе). С ростом расстояния силы отталкивания убывают быстрее, чем силы притяжения. Поэтому кривая энергии связи несимметрична (рис. 1.6). С увеличением температуры, а следовательно, и энергии теплового движения возрастает амплитуда колебаний, но положение равновесия смещается в сторону увеличения расстояния между частицами. Это приводит к увеличению параметра решетки, т. е. к тепловому расширению. Таким образом, термическое расширение тел объясняется не ростом амплитуды тепловых колебаний частиц, а ангармоническим характером этих колебаний.
Мы рассмотрели характер движения частиц в упрощенном случае двухчастичного линейного кристалла. В действительности в пространственной решетке колебания носят сложный характер. Каждая частица испытывает действие сил связи со стороны всех окружающих ее частиц кристалла. Так как силы связи быстро убывают с увеличением расстояния, то учитывают действие только ближайших «соседей». Если изменить характер движения какой-либо одной частицы, то это изменение будет передано соседним частицам, а от них — к их «соседям» и т. д. Например, если тело с одной стороны нагреть, то колебания частиц в этой части кристалла усилятся. Это усиление теплового движения через силы связи передастся соседним частицам и достигнет противоположного конца тела, т. е. повышение температуры в какой-либо части тела приведет к ее повышению в остальных. Такова природа теплопроводности.
Следует отметить, что при этом не происходит направленного перемещения частиц. Они колеблются около своих положений равновесия. В кристалле разные частицы колеблются с разными частотами и в разных фазах. Период колебаний частиц имеет порядок 10-13 с. Таким образом, если мы «сфотографируем» частицы в кристалле с временем экспозиции, меньшим 10-13 с, то никакого порядка в расположении частиц не увидим, так как все они будут находиться на разных расстояниях от положений равновесия. Реально же время экспозиции всегда больше 10-13 с. Поэтому фактически мы увидим частицы в положениях равновесия, т. е. упорядоченную структуру кристалла.
В кристалле энергия теплового движения меньше энергии связи, т. е. E < |Umin|. С увеличением температуры растет энергия теплового движения, и при некоторой температуре она приблизится к энергии связи. При этом произойдет плавление кристалла» т. е. переход в жидкое состояние. Для иллюстрации поведения частиц в кристалле при нагревании рассмотрим изменение энергии связи двух частиц в зависимости от положения между ними средней частицы. Если расстояние между частицами достаточно мало (температура значительно меньше температуры плавления), то энергия средней частицы распределена в соответствии с рис. 1.7, а. При этом средняя частица имеет минимум энергии посредине между крайними частицами, что отвечает правильному расположению частиц в кристалле. Если же крайние частицы раздвинуть на очень большое расстояние, что соответствует испарению металла, то средним положениям частицы будет соответствовать отсутствие сил взаимодействия. Кривая энергии средней частицы при этом показана на рис. 1.7,б. Видно, что на значительных расстояниях между частицами средняя частица не будет испытывать взаимодействия с крайними, как в идеальном газе.

Рис. 1.7. Изменение потенциала средней частицы при малых (а), очень больших (б) и некоторых средних (в) расстояниях между крайними атомами
Рассмотрим случай, когда температура близка к температуре плавления. Крайние частицы находятся на таком расстоянии друг от друга, что энергия связи средней частицы будет изменяться в зависимости от расстояния, как показано на рис. 1.7, в. Положение в центре промежутка между крайними частицами будет неустойчивым и частица перейдет в потенциальную яму около левой или правой частицы. При этом кристалл разрушится. Нарушится дальний порядок в размещении частиц. Частицы первой координационной сферы (ближайшие к данной частице) останутся связанными с этой частицей, а более удаленные потеряют с ней связь. Говорят, что сохранился ближний порядок в размещении атомов. Средняя частица при этом совершает колебания только около одной из указанных на рисунке частиц. Следует, однако, отметить, что данное положение будет динамическим. Глубина потенциальной ямы не столь велика, чтобы средний атом, накопив вследствие флуктуации энергию, не перешел в потенциальную яму около соседней, т. е. правой, частицы. При этом происходит смена положения равновесия колебаний. Описанная картина отвечает жидкому состоянию.
Таким образом, частицы в жидкостях совершают колебания такого же типа, что и в кристаллах, но положения равновесия, относительно которых совершаются колебания, не остаются неподвижными. Совершив некоторое число колебаний около данного положения равновесия, частица скачком переходит в новое положение и продолжает там колебаться, пока снова не перескочит в новое положение. По Я. И. Френкелю, длительность пребывания частицы около данного положения равновесия — время оседлой жизни — определяется по формуле т^т-ое^0^7', где t0 — период колебания около положения равновесия; U0 — высота потенциального барьера, отделяющего два положения равновесия (глубина потенциальной ямы); k — постоянная Больцмана; Т — абсолютная температура. Обычно t имеет порядок 10-10 с. Период же колебаний то имеет порядок 10-12 — 10-13 с. Значит, частица, прежде чем переменить место, совершит 100 — 1000 колебаний.
Молекулы жидкости в основном ведут оседлый образ жизни, что сближает их с молекулами твердых тел. С увеличением температуры время оседлой жизни уменьшается, т. е. снижается доля колебательного движения и увеличивается доля поступательного трансляционного движения. Таким образом, в жидкостях сохраняется на достаточно высоком уровне взаимодействие между частицами, сосуществующее с тепловым движением. Такое состояние в отличие от газов, где энергия взаимодействия значительно меньше энергии теплового движения, называется конденсированным состоянием. Отличие жидкости от твердых кристаллических тел состоит в наличии кроме колебательного движения трансляционного движения, доля которого увеличивается с повышением температуры. Однако для более полного понимания процесса плавления необходимо отметить, что и в твердых телах частицы могут иметь трансляционное движение, усиливающееся по мере приближения к температуре плавления.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 443; Нарушение авторских прав?; Мы поможем в написании вашей работы!