
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Селен, теллур, полоний
|
|
|
|
Сера
Озон
В 1840г. было получено газообразное вещество, состоящее из трех атомов кислорода (О3) и сильно отличающееся по свойствам от обычного кислорода. Новый газ, обладающий характерным запахом, был назван озоном (по-гречески - "пахучий"). Подобно O2, озон представляет собой простое вещество и является аллотропной модификацией кислорода. Для молекулы его вероятна структурная формула
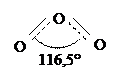 |
В природе озон образуется в атмосфере при грозовых разрядах из O2. Образуется в верхних слоях атмосферы под действием ультрафиолетового излучения солнца, т.е. только днем. В ночное время концентрация озона падает за счет разложения и взаимодействия с микропримесями различных веществ. Содержание озона в атмосфере на высоте 22 км равно 1.10-6%. Озоновый слой сильно влияет на живую природу Земли, поглощая ультрафиолетовое излучение с длиной волны 220-320 нм, которое смертельно для живой природы.
В жидком и твердом состоянии озон является взрывоопасным веществом. Сильнейший окислитель, взаимодействует с веществами при более низких температурах, чем кислород. Бурно реагирует с органическими веществами. Обладает дезинфицирующими свойствами, токсичен.
Очень распространена в природе. Встречается как в самородном состоянии, так и в виде многочисленных минералов (FeS2, As2S3, CaSO4.2H2O, Na2SO4.10H2O и т.д.). Это кристаллическое вещество желтого цвета, не растворимое в воде, с температурой плавления 119оС. Полиморфно, наиболее устойчивая модификация - ромбическая, которая при 90оС переходит в моноклинную.
Химические свойства
1. Сера весьма активный неметалл. Со ртутью взаимодействует при обычной температуре; с углеродом, кислородом, галогенами при нагревании:
|
|
|
Hg + S = HgS
2S + C = CS2
S + O2 = SO2
2S + Cl2 = S2Cl2
2. Легко взаимодействует с концентрированными кислотами и щелочами:
S + 4HNO3 = 4NO2 ↑ + SO2 ↑ + 2H2O
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3. Наиболее устойчивое соединение серы с водородом – сероводород H2S. Сероводород можно получить прямым синтезом из простых веществ, пропуская водород над расплавленной серой. Сероводород – газ с запахом тухлых яиц, очень ядовит. В водном растворе сероводород ведет себя как слабая двухосновная кислота (сероводородная кислота). Соли этой кислоты (сульфиды) окрашены в характерные цвета: ZnS – белый, CdS – желтый, MnS – розоватый, PbS – черный.
4. Сероводород – сильный восстановитель. Если его партнером по взаимодействию является сильный окислитель, то H2S окисляется до серной кислоты, если слабый - окисляется до элементарной серы:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
4Cl2 + H2S + 4H2O = H2SO4 + 8HCl
5. Оксид серы (IV) SO2 получают при обжиге сульфидов:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Очень активное в химическом отношении вещество. С хлором дает соединение SO2Cl2 (хлористый сульфурил), который является хлорангидридом серной кислоты:
SO2Cl2 + 2H2O = H2SO4 + 2HCl
При взаимодействии SO2 с водой образуется неустойчивая сернистая кислота H2SO3 (существует только в водных растворах). Ее соли сульфиты хорошие восстановители:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 +
+ 2MnSO4 + K2SO4 + 3H2O
SO3 – легколетучая жидкость получается из SO2 окислением в присутствии катализатора (платины или оксида ванадия (V)). Основным потребителем SO3 являются сернокислотные заводы.
При взаимодействии SO3 с водой образуется серная кислота. Получившуюся серную кислоту насыщают SO3 и соединение H2SO4 . xSO3 носит название "олеум". Разбавляя олеум водой до 98% получают товарную H2SO4.
Н2S2O7 – дисерная кислота. Ее соли (K2S2O7 и др.) называются пиросульфатами.
6. Концентрированная серная кислота при взаимодействии с металлами образует SO2, S, H2S (в зависимости от активности металла):
|
|
|
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Некоторые металлы (Al, Cr, Fe) холодной концентрированной серной кислотой пассивируются.
7. При взаимодействии неметаллов с концентрированной H2SO4 образуются кислоты (как правило высшие), в состав которых входит данный неметалл:
J2 + 5H2SO4 = 2HJO3 + 5SO2 + 4H2O
C + 2H2SO4 = CO2 + 2H2O + 2SO2
В последнем примере образуется угольная кислота, которая разлагается на CO2 и H2O.
8. Соли серной кислоты (сульфаты и гидросульфаты) довольно устойчивы, но могут разлагаться при интенсивном нагревании:
2CuSO4 = 2CuO + 2SO2 + O2
2NaHSO4 = Na2S2O7 + H2O
В последнем случае образуется соль пиросерной кислоты H2S2O7. Эта кислота находит применение при производстве красителей. При взаимодействии ее с водой образуется серная кислота.
9. При электролизе концентрированного раствора KHSO4 на аноде образуется надсерная кислота H2S2O8. Ее соли (персульфаты) являются сильнейшими окислителями. В свободном состоянии надсерная кислота представляет собой бесцветные гигроскопичные кристаллы. H2S2O8 - сильнейший окислитель (обугливает не только бумагу и сахар, но и парафин). При взаимодействии H2S2O8 с водой образуется пероксид водорода:
H2S2O8 + 2H2O = 2H2SO4 + H2O2
Этим способом получают пероксид водорода в промышленности.
10. При кипячении сульфитов с серой образуются тиосульфаты - соли серноватистой (тиосерной) кислоты H2S2O3. В свободном состоянии кислота неустойчива и распадается в момент получения по уравнению:
H2S2O3 = H2O + SO2 + S ¯
Тиосульфаты хорошие восстановители, используются в текстильной промышленности для удаления избытка хлора при отбеливании последним тканей и фотографии для переведение в растворимое состояние незасвеченного бромида серебра:
Na2S2O3 + 4Cl2 + 5H2O = 2H2SO4 + 6HCl + 2NaCl
2Na2S2O3 + AgBr = Na3[Ag(S2O3)2] + NaBr
11. При пропускании галогенов через расплавленную серу образуются галогениды серы. Практическое значение (для вулканизации каучука) имеет хлорид серы:
2S + Cl2 = S2Cl2
Можно получить и гексагалогениды SCl6, SF6. Последний – инертный газ с высокой диэлектрической постоянной, используется как газовый изолятор в высоковольтных установках.
|
|
|
В природе соединения селена и теллура являются спутниками сульфидов меди, серебра и свинца. Полоний встречается в рудах урана и тория.
Селен обладает незначительной электропроводностью, которая увеличивается под действием света в сотни раз.
Химические свойства
1. Менее активны, чем сера но при нагревании взаимодействуют с металлами, кислородом, галогенами:
Se + Mg = MgSe;
Te + O2 = TeO2;
Te + 2Cl2 = TeCl4
2. Водородные соединения получаются косвенным путем из селенидов и теллуридов под действием соляной кислоты:
MgSe + 2HCl = MgCl2 + H2Se
H2Se и H2Te - газы с отвратительным запахом. В водном растворе ведут себя как кислоты более сильные, чем H2S. Являются сильными восстановителями.
3. С кислородом эти элементы дают оксиды состава SeO2, TeO2, PoO2, SeO3, TeO3, PoO3, которым соответствуют кислоты состава H2ЭO3 и H2ЭО4.
Селенистая кислота H2SeO3 образуется при растворении SeO2 в воде. Теллуристая кислота H2TeO3 получается косвенным путем (из-за плохой растворимости TeO2 в воде):
TeO2 + Na2CO3 = Na2TeO3 + CO2
Na2TeO3 + 2HCl = H2TeO3 + 2NaCl
Соли этих кислот носят название селениты и теллуриты.
4. Для получения соединений в высшей степени окисления +6 необходимо воздействие сильных окислителей:
3H2SeO3 + HClO3 = 3H2SeO4 + HCl
H2SeO4 сильная кислота, H2TeO4 – средней силы. Обе кислоты - сильнейшие окислители. Так, селеновая кислота растворяет золото:
6H2SeO4 + 2Au = Au2(SeO4)3 + 3SeO2 + 6H2O
Соли теллуровой кислоты (теллураты) сильные окислители, в отличии от соответствующих сульфатов:
Na2TeO4 + 2HCl = Na2TeO3 + Cl2 + H2O
Соединения селена и теллура используются в полупроводниковой технике, в некоторых сплавах специального назначения.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1432; Нарушение авторских прав?; Мы поможем в написании вашей работы!