
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики
|
|
|
|
Несмотря на всю важность и общность первого начала термодинамики, оно оказалось недостаточным для полного описания термодинамических процессов и систем.
Недостатками первого начала являются:
1. Теплота (Q), входящая в уравнение, не выражена через параметры системы.
2. Не указывается направление процессов, происходящих в системе, и условия достижения равновесного состояния.
Эти недостатки легко просматриваются на простом примере падения тела в поле силы тяжести (рис. 9).
Стр. 50

Рис. 9. Схема падения тела
При падении тела из положения 1 в положение 2 наблюдается переход потенциальной энергии в кинетическую. При резкой остановке тела в положении 2 кинетическая энергия переходит в тепловую энергию хаотического движения частиц тела, опоры, воздуха и в виде тепла рассеивается в окружающем пространстве. Первому началу термодинамики не противоречил бы и обратный процесс: тело в положении 2 отбирает энергию из окружающей среды, охлаждая ее, и переходит, имея запас энергии, в положение 1.
Хорошо известно, что многие процессы, происходящие в реальном мире, необратимы. Направленность тех или иных процессов и является объектом описания второго начала термодинамики.
Второе начало термодинамики было впервые сформулировано Р. Кла-узиусом (1850) как обобщение фактов, наблюдаемых при изучении процессов теплопередачи: «Теплота не может сама собой переходить от холодного тела к нагретому».
В 1854 г. Р. Клаузиус вводит понятие энтропии (S) - некоторой функции состояния, изменение которой при температуре Т определяется для изолированной системы соотношением

Стр. 51
При обратимых процессах полное изменение энтропии 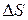 системы равно нулю. Однако если процесс необратим, то изменение энтропии
системы равно нулю. Однако если процесс необратим, то изменение энтропии 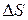 больше нуля, т. е. энтропия в изолированных системах при протекании необратимых процессов возрастает (
больше нуля, т. е. энтропия в изолированных системах при протекании необратимых процессов возрастает (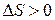 ).
).
|
|
|
Величина 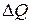 - количество теплоты, полученное или отданное системой вследствие необратимых процессов, протекающих внутри системы.
- количество теплоты, полученное или отданное системой вследствие необратимых процессов, протекающих внутри системы.
Отсюда если система изолирована и находится в равновесном состоянии, то  , а следовательно, и
, а следовательно, и 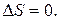 Если же изолированная система находится в неравновесном состоянии, то
Если же изолированная система находится в неравновесном состоянии, то 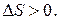 Значит, для изолированных систем с помощью энтропии можно предсказать направление самопроизвольных процессов (они идут в сторону равновесного состояния).
Значит, для изолированных систем с помощью энтропии можно предсказать направление самопроизвольных процессов (они идут в сторону равновесного состояния).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!