
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статистическая природа второго начала термодинамики
|
|
|
|
Классическая термодинамика рассматривает макросистемы, не вникая в корпускулярную структуру. Почему в системе происходят процессы, приводящие ее из неравновесного состояния в равновесное, почему такие процессы являются необратимыми - на эти вопросы дает ответы статистическая физика.
Другой независимый способ рассмотрения тех же самых систем может быть реализован молекулярно - статистическим методом, который основывается на микроскопическом изучении поведения отдельных частиц, составляющих систему, и позволяет установить взаимосвязи между статистически усредненными параметрами этих частиц и макроскопическими параметрами термодинамической системы в целом.
В качестве примера системы, состоящей из большого числа частиц, можно рассматривать газ. Макросостояние газа определяется его параметрами: давлением, объемом и температурой. Микросостояние определяется координатами и скоростями движения его молекул в данный момент времени. Ясно, что микросостояние газа постоянно изменяется и для данного макросостояния мы имеем большое число микросостояний. Чем большее число микросостояний отвечает данному макросостоянию, тем легче оно возникает.
Пусть, например, имеется сосуд с разными газами, разделенными перегородкой с закрытым клапаном. Эти газы находятся в тепловом равновесии при одинаковом давлении Если клапан открыть, то через некоторое время из-за хаотического теплового движения произойдет полное смешение обоих газов и получится однородная смесь газов во всем объеме сосуда.
Стр. 52
Равномерное распределение молекул газа по всему объему будет более вероятным состоянием газа, чем вариант, когда смесь газа сама собой разделится на два отдельных компонента в одной и другой частях сосуда. Такое макросостояние (раздельные компоненты газа) реализуется меньшим числом способов, чем равномерное распределение, и представляется практически невероятным. Таким образом, смешение - процесс необратимый.
|
|
|
Введение Л. Больцманом (1872) понятия термодинамической вероятности W как числа микросостояний, посредством которых реализуется данное макросостояние, позволило интерпретировать энтропию (S) с точки зрения вероятностного состояния системы:
S = k 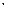 lnW,
lnW,
где k - постоянная Больцмана.
Таким образом, S - функция состояния системы, определяемая термодинамической вероятностью, в изолированной системе может изменяться только в сторону возрастания (если система неравновесна) или оставаться постоянной (если система находится в равновесном состоянии), т. е. 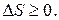
Если система находится в неравновесном состоянии, т. е. температура, давление, концентрация и т. д. в разных ее частях различны (W1 S1), то с течением времени наиболее вероятным станет такое ее состояние, когда эти параметры выравняются (W2, S2), причем W2 > W1 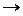 S2 > S1. Значит,
S2 > S1. Значит, 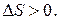
Отметим, что когда в системе наступает термодинамическое равновесие и энтропия достигает своего максимального значения S = S max, то 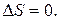
Используя статистическое рассмотрение энтропии, часто вводят понятие «порядок» или «беспорядок», т. е. энтропия - мера беспорядка. Так, если взять кусок льда и поместить его в большой стеклянный куб (система замкнута) при комнатной температуре, то с течением времени будет наблюдаться изменение состояния льда (молекул воды во льде). В начальном состоянии молекулы воды, находясь в узлах кристаллической решетки льда, будут иметь состояние, определяемое термодинамической вероятностью W1, а значит, и S1). По мере нагревания лед постепенно переходит в жидкое состояние с W2 > W1 (S2 > S1), т. е. беспорядок молекул воды стал больше, чем у молекул льда. Дальнейший нагрев воды до комнатной температуры (опыт проводили в термостате) приводит к ее испарению, превращению в пар с W3, S3, которые имеют большее значение, чем для воды (W2, S2). Таким образом, с ростом энтропии в изолированной системе беспорядок увеличивается.
|
|
|
Стр. 53
После формулировки второго начала термодинамики Л. Больцманом возникла драматическая гипотеза «тепловой смерти Вселенной». По словам Р. Клаузиуса, энтропия Вселенной возрастает. Все виды энергии во Вселенной перейдут в энергию теплового движения, равномерно распределенного по веществу. Все макроскопические процессы, определяющиеся переносом энергии, массы, заряда, прекратятся.
Действительно, при таком «сценарию) развития Солнце и звезды в какой-то момент израсходуют запасы свободной энергии, излучив их во всех направлениях. Звезды погаснут, и все существующие перепады температур выравняются, все тела приобретут некоторую одинаковую среднюю температуру. При этом в соответствии с законом сохранения энергии полная энергия Вселенной сохранится, но исчезнет вся жизнь, ни одна машина не сможет прийти в движение.
Почему такая гипотеза несостоятельна?
Во-первых, второе начало термодинамики было сформулировано на основе обобщения опытных данных, относящихся к ограниченным, хотя и большим, макросистемам. Для распространения же этого начала на всю Вселенную нет оснований.
Во-вторых, Вселенная не является изолированной системой. Согласно современным данным, она неоднородна, нестационарна и бесконечна.
В-третьих, в космическом масштабе определяющее значение во взаимодействии отдельных частей Вселенной имеют гравитационные силы, что обусловливает существенную роль в эволюции больших флуктуации, случайностей. В данном случае, когда гравитационная энергия макроскопических частей сталкивается с соизмеримой по величине их внутренней энергией, мы имеем систему, которая в целом не является чисто термодинамической, т. е. второе начало термодинамики нельзя применят/ к большим участкам Вселенной, а тем более ко всей Вселенной как целому.
Стр. 54
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1331; Нарушение авторских прав?; Мы поможем в написании вашей работы!