
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 20. Елементи VIIIA групи 2 страница
|
|
|
|
5.90. Вкажіть формулу сульфіду, який під час гідролізу зумовлює лужну реакцію середовища:
A) Al2S3;
B) Na2S;
C) SiS2;
D) Cr2S3;
E) P2S5.
5.91. Визначте коефіцієнти в рівнянні: FeS2 + O2 ® F2O3 + SO2
5.92. Вкажіть, яка кислота утвоюється при розчиненні сульфур (IV) оксиду в воді:
A) сульфатна;
B) тіосульфатна;
C) сульфідна;
D) сульфітна;
E) тетратіонатна.
5.93. Вкажіть продукти реакції при підкисленні розчину натрій тіосульфату, розставте коефіцієнти в рівнянні: Na2S2O3 + H2SO4 ® Na2SO4 + ___ + ___ + H2O
A) SO3 + S;
B) H2S + S;
C) SO2 + S;
D) SO2 + H2S;
E) SO3 + H2S.
5.94. Визначте продукт реакції окиснення натрій тіосульфату йодом, яка лежить в основі одного з методів титриметричного аналізу – йодометрії, розставте коефіцієнти в рівнянні: Na2S2O3 + I2 ® NaI + …
A) Na2SO3;
B) Na2SO4;
C) Na2S2O5;
D) Na2S2O7;
E) Na2S4O6.
5.95. Вкажіть формулу дисульфатної кислоти:
A) H2S2O3;
B) H2S2O5;
C) H2S2O8;
D) H2S4O6;
E) H2S2O7.
5.96. Вкажіть формули речовин, які можуть проявляти окисно-відновну двоїстість:
A) H2S;
B) SO3;
C) SO2;
D) H2SO3;
E) H2SO4.
5.97. Зазначте продукти відновлення концентрованої сульфатної кислоти при дії на активні метали (цинк, магній тощо):
A) S;
B) SO2;
C) SO3;
D) H2SO3;
E) H2S.
5.98. Вкажіть продукт відновлення концентрованої сульфатної кислоти при окисненні нею міді, срібла і ртуті:
A) H2S;
B) S;
C) SO3;
D) SO2;
E) H2S2O3.
5.99. Вкажіть продукт відновлення концентрованої сульфатної кислоти при окисненні нею фосфору, сірки і вуглецю:
A) S;
B) H2S;
C) SO2;
D) SO3;
E) H2S2O7.
5.100. Вкажіть продукт окиснення Se концентрованою нітратною кислотою, розставте коефіцієнти в рівнянні реакції: Se + HNO3(конц) ® ... + NO2 + H2O
A) SeO2;
B) SeO3;
C) H2Se;
D) H2SeO3;
E) H2SeO4
5.101. Закінчіть рівняння реакції, розставте коефіцієнти:
Po + HNO3(конц) ® ... +... + H2O
5.102. Закінчіть рівняння реакції, розставте коефіцієнти:
SeO2 + SO2 + H2O ® ... +...
5.103. Закінчіть рівняння реакції, розставте коефіцієнти:
Te + HClO3 + H2O ® ... +...
|
|
|
5.104. Визначте, як змінюються в ряду N – P – As – Sb – Bi значення радіусів атомів та відносних електронегативностей (ВЕН) атомів:
A) радіуси атомів зменшуються, ВЕН зменшується;
B) радіуси атомів зменшуються, ВЕН зростає;
C) радіуси атомів збільшуються, ВЕН зменшується;
D) радіуси атомів збільшуються, ВЕН зростає;
E) радіуси атомів збільшуються, ВЕН не змінюється.
5.105. Вкажіть, в результаті термічного розкладу яких речовин в лабораторії можна одержати азот:
A) NaNO3 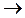 ;
;
B) NH4NO2 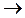 ;
;
C) (NH4)2Cr2O7 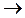 ;
;
D) NaN3 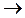 ;
;
E) N2O 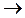 .
.
5.106. Зазначте, за допомогою яких зв’язків в молекулі N2 атоми сполучені потрійним хімічним зв’язком:
A) трьох σ-зв’язків;
B) трьох π-зв’язків;
C) двох σ-зв’язків і одного π-зв’язку;
D) одного σ-зв’язку і двох π-зв’язків;
E) одного σ-зв’язку, одного π-зв’язку і одного донорно-акцепторного зв’язку.
5.107. Вкажіть, яку максимальну валентність може проявляти Нітроген (включаючи і донорно-акцепторний механізм утворення ковалентногозв’язку):
A) III;
B) II;
C) IV;
D) I;
E) V.
5.108. Визначте, який хімічний елемент в ряду N – P – As – Sb – Bi найлегше утворює сполуки з Гідрогеном і, відповідно, вкажіть найбільш стійку летку гідрогеновмісну сполуку елементів VА групи:
A) N, NH3;
B) P, PH3;
C) As, AsH3;
D) Sb. SbH3;
E) Bi, BiH3.
5.109. Визначте продукт окиснення амоніаку під час пропускання суміші амоніаку і повітря над платино - родієвим каталізатором за температури 750°С. Визначте коефіцієнти в рівнянні: NH3 + O2 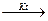 ___ + H2O
___ + H2O
A) N2;
B) N2O;
C) NO;
D) N2O3;
E) NO2.
5.110. Визначте продукт горіння амоніаку без каталізатора. Визначте коефіцієнти в рівнянні реакції: NH3 + O2  ___ + H2O
___ + H2O
A) N2;
B) N2O;
C) NO;
D) N2O3;
E) NO2.
5.111. Закінчіть рівняння реакції, розставте коефіцієнти:
(NH4)2SO4 + K2Cr2O7 ® ___ + ___ + K2SO4 + H2O
5.112. Виберіть правильні віповіді, які характеризують солі амонію:
A) більшість солей амонію добре розчиняються у воді;
B) за розчинністю солі амонію подібні до солей калію;
C) солі амонію в водних розчинах гідролізуютьcя;
|
|
|
D) солі амонію відрізняються віл солей лужних металів леткістю при нагріванні;
E) солі амонію можуть розкладатися оборотно і необоротно.
5.113. Вкажіть речовину, в якій Нітроген виявляє тільки відновні властивості:
A) N2O;
B) NO;
C) N2H4;
D) NaNO3;
E) NH3.
5.114. Вкажіть речовину, в якій Нітроген виявляє тільки окисні властивості:
A) NO2;
B) NH3;
C) AgNO2;
D) HNO3;
E) NH4Cl.
5.115. Вкажіть речовину, в якій Нітроген може виявляти як окисні, так і відновні властивості:
A) NH4F;
B) KNO2;
C) Ca(NO3)2;
D) (NH4)2Cr2O7;
E) NH2OH.
5.116. Встановіть відповідність між хімічними формулами та назвами гідрогеновмісних сполук Нітрогену:
| Хімічна формула: | Назва сполуки |
| 1) NaNH2; 2) Na2NH; 3) N2H4; 4) HN3; 5) NH2OH. | A) гідразин; B) … амід; C) … імід; D) гідроксиламін; E) азидна кислота. |
5.117. Зазначте ступінь окиснення атома Нітрогену в молекулі гідразину:
A) + 3;
B) + 2;
C) -2;
D) + 1;
E) -1.
5.118. Зазначте ступінь окиснення атома Нітрогену в молекулі гідроксиламіну:
A) -3;
B) -2;
C) + 2;
D) -1;
E) + 1.
5.119. Закінчіть рівняння реакції, розставте коефіцієнти:
N2H4 + KMnO4 + H2SO4 ® ___ + ___ + K2SO4 + H2O
5.120. Закінчіть рівняння реакції, розставте коефіцієнти:
FeSO4 + NH2OH + H2SO4 ® ___ + ___ + H2O
5.121. Закінчіть рівняння реакції, розставте коефіцієнти:
KI + NaNO2 + H2SO4 ® ___ + ___ + K2SO4 + Na2SO4 + H2O
5.122. Вкажіть речовини, з якими взаємодіє розбавлена нітратна кислота:
A) S;
B) Au;
C) P;
D) Rh;
E) C.
5.123. Вкажіть продукти відновлення розбавленої нітратної кислоти при взаємодії з металами:
| Метал | Продукти відновлення |
| 1. Cu; 2. Fe; 3. Zn; 4. Mg; 5. Sn. | A)NO2; B)N2O; C)NO; D)N2; E)NH4NO3. |
5.124. Зазначте продукт відновлення дуже розбавленої нітратної кислоти при взаємодії з залізом або магнієм:
A) NO;
B) NO2;
C) N2;
D) NH4NO3;
E) N2O.
5.125. Вкажіть прості речовини, які не розчиняються у концентрованій нітратній кислоті завдяки утворенню на їхній поверхні стійких оксидних плівок:
A) Fe;
B) Cr;
C) Si;
D) Hg;
E) Ti.
5.126. Закінчіть рівняння реакції, розставте коефіцієнти:
Au + HNO3 + HCl ® H[AuCl4] + ___ + H2O
5.127. Вкажіть формули нітратів, які при термічному розкладі перетворюються в оксиди:
A) KNO3;
B) Cu(NO3)2;
C) Pb(NO3)2;
D) Hg(NO3)2;
E) AgNO3.
5.128. Закінчіть рівняння реакції:
AI + KNO3 + KOH + H2O ® K[AI(OH)4] + ___
5.129. Вкажіть, як змінюється міцність зв’язків E-H і E-O при переході від N до P:
A) міцність зв’язків E-H і E-O зростає;
B) міцність зв’язку E-H зростає, а зв’язку E-O послаблюється;
|
|
|
C) міцність зв’язку E-H послаблюється, а зв’язку E-O зростає;
D) міцність зв’язків E-H і E-O послаблюється;
E) міцність зв’язку E-H послаблюється, а зв’язку E-O не змінюється.
5.130. Зазначте максимальне координаційне число для Фосфору:
A) 2;
B) 5;
C) 4;
D) 6;
E) 8.
5.131. Зазначте характерні для Фосфору ступені окиснення:
A) -3;
B) -2;
C) -1;
D) 0;
E) + 1;
F) + 2;
G) + 3;
H) + 4;
I) + 5.
5.132. Встановіть відповідність між формулами фосфоровмісних сполук і ступенями окиснення Фосфору – 1) P4; 2) PH3; 3) Mg3P2; 4) PH4F; 5) POCl3:
| Хімічна формула | Ступені окиснення Фосфору |
| 1. P4; 2. PH3; 3. Mg3P2; 4. PH4F; 5. POCl3. | A)-3; B)-2; C)-1; D)0; E)+1; F)+2; G)+3; H)+4; I)+5. |
5.133. Вкажіть склад фосфоровмісного мінералу фосфориту:
A) P2O5;
B) CaHPO4;
C) Ca(H2PO4)2;
D) Ca3(PO4)2;
E) Ca(PO3)2.
5.134. Вкажіть складові Х фосфоровмісного мінералу апатиту (Ca5 X (PO4)3:
A) F;
B) Cl;
C) Br;
D) I;
E) OH.
5.135. Зазначте сполуку, відновленням якої в промисловості одержують фосфор:
A) PCl3;
B) PCl5;
C) Ca3P2;
D) Ca(PO3)2;
E) Ca3(PO4)2.
5.136. Закінчіть рівняння реакції, розставте коефіцієнти: Ca3(PO4)2 + C + SiO2 →
5.137. Вкажіть склад молекули білого фосфору:
A) P8;
B) P2;
C) P4;
D) P6;
E) P5.
5.138. Закінчіть рівняння реакції, розставте коефіцієнти:
P + HNO3 + H2O → ___ + NO↑
5.139. Закінчіть рівняння реакції, розставте коефіцієнти:
P4 + NaOH + H2O → ___ + NaH2PO2
5.140. Встановіть відповідність між назвами та формулами фосфоровмісних
сполук:
| Назва сполуки | Хімічна формула |
| 1. фосфін; 2. фосфід; 3. фосфорит; 4. сіль фосфонію; 5. дифосфін. | J)P2H4; K)Ca3(PO4)2; L)PH4Cl; M)PH3; N)Mg3P2. |
5.141. Вкажіть рівняння реакцій, в результаті здійснення яких може бути одержаний фосфін:
A) Ca3P2 + H2O →;
B) Ca3P2 + HCl →;
C) P4 + Ba(OH)2 + H2O →;
D) P2H4 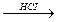 ;
;
E) H3PO3 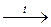 .
. 
5.142. Зазначте продукти реакції гідролізу фосфор (V) хлориду в гарячій воді:
PCl5 + HOH →
A) Cl2 + PH3;
B) Cl2 + HPO3;
C) HClO + PCl3;
D) HCl + H3PO4;
E) HCl + P2H4.
5.143. Встановіть відповідність між назвами та хімічними формулами фосфоровмісних кислот:
| Формула кислоти | Назва кислоти |
| 1. HPO3; 2. H3PO2; 3. H3PO3; 4. H4P2O7; 5. H3PO4. | A)фосфітна; B)гіпофосфітна; C)ортофосфатна; D)дифосфатна; E)метафосфатна. |
5.144. Зазначте ступінь окиснення атома Фосфору в молекулах фосфоровмісних кислот:
| Назва кислоти | Ступені окиснення Фосфору |
| 1. дифосфатна; 2. фосфітна; 3. метафосфатна; 4. гіпофосфітна; 5. ортофосфатна. | A)+ 3; B)+ 2; C)+ 4; D)+ 1; E)+ 5. |
5.145. Встановіть відповідність між хімічними формулами фосфоровмісних солей і ступенями окиснення Фосфору:
|
|
|
| Хімічна формула | Ступені окиснення Фосфору |
| 1. BaHPO3; 2. KH2PO2; 3. NaH2PO3; 4. K2HPO4; 5. Ca(H2PO2)2. | A)+ 1; B)+ 4; C)+ 3; D)+ 5; E)+ 2. |
5.146. Вкажіть рівняння реакцій, які використовуються для промислового одержання ортофосфатної кислоти:
A) P2O5 + H2O →;
B) PCl5 + H2O →;
C) P + HNO3 + H2O →;
D) Ca3(PO4)2 + H2SO4 →;
E) H3PO3 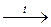 .
.
5.147. Встановіть відповідність між назвами фосфорних мінеральних добрив і їх хімічним складом:
| Назви мінеральних добрив | Хімічний склад |
| 1) простий суперфосфат; 2) подвійний суперфосфат; 3) преципітат; 4) амофос; 5) нітрофоска | А) CaHPO4; В) Ca(H2PO4)2; С) (NH4)2HPO4 · KNO3; D) Ca(H2PO4)2 + 2CaSO4; E) NH4H2PO4 + (NH4)2HPO4. |
5.148. Вкажіть, які відновники застосовують для одержання металічних арсену, бісмуту і стибію на кінцевій стадії відновлення з оксидів:
A) вуглець;
B) кальцій;
C) водень;
D) карбон (II) оксид;
E) магній.
5.149. Вкажіть рівняння реакцій, за допомогою яких може бути одержаний арсен:
A) AsCl3 + H2O 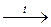 ;
;
B) As + H2 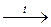 ;
;
C) Mg3As2 + HCl →;
D) As + HCl 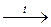 ;
;
E) As2O3 + Zn + HCl →. 
5.150. Закінчіть рівняння реакції, розставте коефіцієнти:
Sb + HNO3(конц) + H2O → ____ + ____
5.151. Зазначте продукти реакції: Bi + HNO3 (розб) →
A) H2;
B) N2;
C) H2O;
D) NO;
E) Bi(NO3)3;
F) NH4NO3;
G) Bi2O5.
5.152. Зазначте продукти реакції гідролізу бісмут (III) нітрату:
Bi(NO3)3 + HOH →
A) Bi(OH)3;
B) Bi(OH)2NO3;
C) BiONO3;
D) HNO3;
E) BiOH(NO3)2.
5.153. Закінчіть рівняння реакції, розставте коефіцієнти:
___MnSO4 + ___KBiO3 + __H2SO4 → ___ + ___ + ___K2SO4 + ___H2O
5.154. Вкажіть мінерали, до складу яких переважно входять карбонати:
A) доломіт;
B) кальцит;
C) корунд;
D) магнезит;
E) сидерит.
5.155. Позначте стрілками електрони в графічній схемі електронної будови атома C:
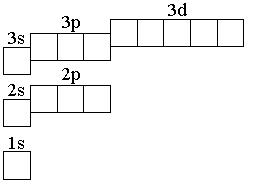 .
.
5.156. Позначте стрілками електрони в графічній схемі електронної будови атома C* (у збудженому стані):
 .
.
5.157. Вкажіть природні ізотопи Карбону, вміст яких в Земній корі >1%:
A) 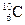 ;
;
B) 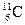 ;
;
C) 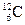 ;
;
D) 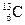 ;
;
E) 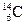 .
.
5.158. Закінчіть рівняння реакції, що відбувається при утворенні ізотопу 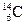 із
із 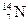 під дією космічних променів:
під дією космічних променів: 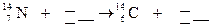 .
.
5.159. Закінчіть рівняння реакції на якому ґрунтується радіокарбоновий метод геохронології: 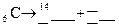 .
.
5.160. Вкажіть алотропні модифікації Карбону:
A) алмаз;
B) бітум;
C) графіт;
D) нафта;
E) фуллерен.
5.161. Знайдіть відповідність між кристалічною ґраткою і речовиною:
1.  ; 2
; 2 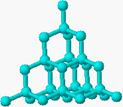 ; 3
; 3 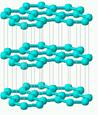 ;
;
А) алмаз; B) графіт; C) фуллерен.
5.162. Вкажіть валентність Карбону в органічних сполуках:
A) 1;
B) 2;
C) 3;
D) 4;
E) 5.
5.163. Розмістіть сполуки в порядку зростання відстані С-С:
A) алмаз;
B) ацетилен;
C) бензол;
D) графіт;
E) етилен.
5.164. Вкажіть сполуки, в яких атом Карбону знаходиться в стані sp - гібридизації:
A) CO2;
B) COCl;
C) CSCl2;
D) CОS;
E) СCl4.
5.165. Вкажіть концентрацію CO2 в повітрі (%об.):
A) 0,01;
B) 0,03;
C) 10;
D) 20;
E) 25.
5.166. Установіть відповідність між формулою і назвою речовини:
A) COCl2; 1) калій ціанід;
B) Fe(CNS)3; 2) кальцій карбід;
C) Fe(CO)5; 3) ферум карбоніл;
D) KCN; 4) ферум тіоцианат;
E) СaC2; 5) фосген.
5.167. Вкажіть, який об’єм СO2 (н.у.) виділиться при взаємодії 2,4г Карбону з киснем:
A) 2,24л;
B) 22,4л;
C) 4,48л;
D) 44,8л;
E) 56,0л.
5.168. Вкажіть продукти хімічної реакції: Al2(SO4)3 + K2CO3 + H2O®:
A) Al(OH)3;
B) Al2(CO3)3;
C) CO2;
D) H2SO4;
E) K2SO4.
5.169. Вкажіть, при додаванні розчину Na2CO3 до розчинів яких солей випадають основні карбонати:
A) CaCl2;
B) CuCl2;
C) FeCl3;
D) NiCl2;
E) ZnCl2.
5.170. Вкажіть, при додаванні розчину Na2CO3 до розчинів яких солей випадають середні карбонати:
A) AlCl3;
B) BaCl2;
C) CaCl2;
D) NaCl;
E) SrCl2.
5.171. Вкажіть речовини, при взаємодії з якими Карбон проявляє відновні властивості:
A) Al;
B) CuO;
C) H2;
D) HNO3;
E) СO2.
5.172. Вкажіть продукти хімічної реакції: COCl2 + Ca(OH)2(надлишок) ®:
A) Ca(ClO)2;
B) Ca(HCO3)2;
C) CaCl2;
D) CaCO3;
E) H2O.
5.173. Установіть послідовність збільшення реакційної здатності сполук:
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 435; Нарушение авторских прав?; Мы поможем в написании вашей работы!