
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конденсаційні методи одержання колоїдних систем
|
|
|
|
Ця група методів вигідна з енергетичної точки зору, адже укрупнення частинок шляхом об'єднання атомів або молекул під дією ван-дер-ваальсових сил відбувається без витрати енергії ззовні. При цьому залежно від умов конденсації можна одержати системи будь-якого ступеня дисперсності. В основі конденсаційних методів лежить утворення частинок дисперсної фази з пересиченого розчину або з пари за певних фізичних і хімічних умов.
Конденсаційні методи одержання колоїдних систем поділяють на фізичні та хімічні.
Методи фізичної конденсації ґрунтуються тільки на фізичних явищах без перебігу хімічних реакцій (конденсація пари, заміна розчинника тощо).
1. Конденсація пари. Наочним прикладом одержання золів шляхом конденсації пари є утворення аерозолів – туману, диму. Із зниженням температури тиск пари стає дещо більшим за рівноважний тиск над рідиною (або твердим тілом), в результаті чого у газовій фазі утворюються краплинки рідини (туман) або тверді частинки (дим). Ліозолі одержують під час одночасної конденсації пари речовин, що утворюють дисперсну фазу і дисперсійне середовище.
2. Метод заміни розчинника ґрунтується на заміні дисперсійного середовища, що відбувається при додаванні невеликої кількості істинного розчину речовини до розчинника, в якому ця речовина нерозчинна або малорозчинна (обидва розчинники повинні необмежено змішуватися). Це призводить до утворення високодисперсної системи. Як приклад можна навести одержання гідрозолів сірки, каніфолі, ефірних олій, смол, які легко розчиняються в етанолі, але практично нерозчинні у воді. Тому, якщо невеликий об'єм молекулярного розчину сірки в етанолі (істинний розчин) влити у воду, то одержаний водно-спиртовий розчин стане пересиченим, що призведе до агрегації молекул сірки з утворенням злегка каламутного золю.
|
|
|
Методи хімічної конденсації. В основі цих методів лежать хімічні реакції, що супроводжуються утворенням малорозчинних речовин. З цією метою головним чином використовують реакції подвійного обміну, відновлення, окиснення та гідролізу. Високодисперсні системи одержують при додаванні до розбавленого розчину одного реактиву невеликої кількості концентрованого розчину іншого реактиву. Останній відіграє роль стабілізатора колоїдної системи. Нова дисперсна фаза, що складається з агрегатів нерозчинної речовини, спочатку часто має аморфну будову, а з часом набуває кристалічної структури.
Отже, щоб одержати золь, необхідно виконати три умови:
· дисперсна фаза має бути нерозчинною у дисперсійному середовищі;
· у системі має бути стабілізатор, який надає їй стійкості;
· частинки дисперсної фази мають колоїдний ступінь дисперсності (d = 10–7–10–9 м).
При одержанні золів методом хімічної конденсації стабілізатором є одна з реагуючих речовин, що взята в надлишку, або ним може бути електроліт, що утворюється внаслідок перебігу паралельної реакції.
Реакції подвійного обміну дають змогу одержати золі малорозчинних сполук: сульфатів, карбонатів, сульфідів, фосфатів багатьох металів, галогенідів аргентуму, силікатної кислоти тощо.
Одержання золю аргентум йодиду. При змішуванні розбавлених розчинів аргентум нітрату та калій йодиду за умови, що один із реагентів є у надлишку, аргентум йодид не випадає в осад, а утворюється злегка каламутний колоїдний розчин.
а) Нехай до розчину AgNO3 краплями додають розчин КІ. Отже, AgNO3, взятий у надлишку, є стабілізатором. При цьому відбувається така хімічна реакція:
AgNO3 + KI → AgI (т) + KNO3.
Розглянемо на цьому прикладі будову колоїдних частинок ліофобних золів.
|
|
|
Будова колоїдних частинок. Згідно з міцелярною теорією будови колоїдних розчинів, золь складається із структурних частинок дисперсної фази – міцел і міжміцелярної рідини. Міцела має значно складнішу будову за молекулу і є більш високоорганізованою структурною одиницею матерії. У міжміцелярній рідині (дисперсійному середовищі) розчинені електроліти, неелектроліти, поверхнево-активні речовини, які стабілізують колоїдну систему.
У першому наближенні в структурі міцели можна виділити три основні частини: ядро, адсорбційний і дифузний шари йонів.
Основу колоїдних частинок золю аргентум йодиду складають молекули (мікрокристали) малорозчинного AgI, сукупність яких (m молекул) утворює агрегат:
(mAgI) – агрегат.
На поверхні агрегату, за правилом Панета – Фаянса, вибірково адсорбуються ті йони стабілізатора, які можуть добудовувати кристалічну ґратку твердої фази. Ці йони визначають знак і величину потенціалу поверхні і тому їх називають потенціалвизначальними йонами (ПВЙ). Якщо реакція відбувається за надлишку AgNO3, то на поверхні агрегату (m AgI) виникає позитивно заряджений шар з n йонів Ag+ (потенціалвизначальні йони). Агрегат з ПВЙ, які увійшли до його складу, називають ядром:
[(mAgI) nAg+]n+ – ядро
Під дією електростатичних сил до поверхні ядра притягуються йони стабілізатора протилежного знаку (у даному випадку, NO3–), які називають протийонами. Частина протийонів (n – x) NO3–, яка зазнає дії як електростатичних, так і ван-дер-ваальсових сил ядра, утримується на досить близькій відстані від нього і утворює адсорбційний шар протийонів. Ядро разом з адсорбційним шаром протийонів утворює колоїдну частинку – гранулу, знак заряду якої визначається знаком заряду потенціалвизначальних йонів:
{[(mAgI) nAg+]n+ (n- x)NO3–} x + – гранула.
Решта х протийонів NO3–, яка необхідна для повної компенсації заряду поверхні, слабше зв'язана з ядром (діють тільки сили електростатичного притягання), поступово дифундує у напрямку розчину і утворює дифузний шар. Сумарний заряд усіх протийонів дорівнює за величиною заряду поверхні ядра, тобто сумарному заряду потенціалвизначальних йонів. Гранула разом із дифузним шаром утворює електронейтральну міцелу, будову якої в цілому зручно представляти у вигляді формули. У наведеному прикладі, коли стабілізатором є AgNO3, гранула має позитивний заряд і будова міцели має такий вигляд:
|
|
|
{[(mAgI) nAg+]n+ (n- x)NO3–} x + x NO3–.
б) Якщо стабілізатором цього золю є КІ, то одержимо золь AgI з негативним зарядом гранули:
{[(mAgI) nI–]n– (n- x)K+} x – x K+.
Отже, змінюючи співвідношення між кількостями реагуючих речовин, можна одержати золь з позитивним або негативним зарядом гранул. Будова міцели золю аргентум йодиду з позитивним і негативним зарядом гранул зображена на рис. 2.2.
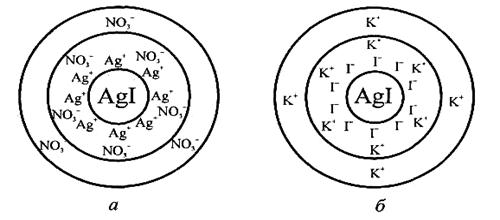
Рис. 2.2. Будова міцели золю аргентум йодиду з позитивним (а) і негативним (б) зарядом гранул
Золь берлінської блакиті одержують в результаті реакції між розчинами солі Ферум (Ш) Fe3+ і калій гексаціаноферату(П) (жовтої кров'яної солі):
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6] (т) + 3KCl, або
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 (т) + 12KCl
При надлишоку FeCl3 на агрегаті адсорбуються потенціалвизначальні йони Fe3+ (правило Панета – Фаянса) і гранули мають позитивний заряд. Будова міцели:
{[(mKFe[Fe(CN)6]) nFe3+]3n+ 3(n- x)Cl–}3 x + 3 x Cl–, або
{[(mFe4[Fe(CN)6]3) nFe3+]3n+ 3(n- x)Cl–}3 x + 3 x Cl–.
Реакцією гідролізу одержують золі гідроксидів Феруму (Ш), Алюмінію, Хрому (Ш), Купруму, Цинку тощо. З цією метою розчин солі відповідного металу доливають до киплячої води. Наприклад, у гарячій воді гідроліз FeCl3 відбувається до кінця:
FeCl3 + 3HOH → Fe(OH)3 (т) + 3HCl.
Проте утворення осаду не спостерігається. Під час перебігу паралельної реакції:
Fe(OH)3 + HCl → FeOCl + 2H2O
утворюється електроліт FeOCl, який виконує функцію стабілізатора. Будова міцели:
{[(mFe(OH)3) nFeO+]n+ (n- x)Cl–} x + x Cl–.
Одночасно утворюється золь ферум (Ш) гідроксиду, міцела якого має таку будову (стабілізатор – надлишок FeCl3):
{[(mFe(OH)3) nFe3+]3n+ 3(n- x)Cl–}3 x + 3 x Cl–.
Порівнюючи конденсаційні та диспергаційні методи одержання дисперсних систем, можна зробити висновок, що для одержання систем із необхідним ступенем дисперсності (d = 10–7 – 10–9 м) придатні в основному методи конденсації, які практично не потребують енергетичних витрат. Однак більшого практичного застосування набули методи диспергування.
|
|
|
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 6710; Нарушение авторских прав?; Мы поможем в написании вашей работы!