
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектры излучения атомов
|
|
|
|
1. С появлением первых спектральных приборов началось изучение спектров излучения и поглощения различных тел. К началу ХХ в. Было известно, что раскаленные тела излучают сплошной спектр, в котором излучение происходит на любой длине волны из широкого диапазона. Газы в атомарном состоянии дают линейчатый спектр, содержащий большое количество более-менее узких спектральных линий. Линейчатый спектр дают также ионы атомов. В молекулярном состоянии газы излучают полосатые спектры. При малой разрешающей силе спектрального прибора полосы в этих спектрах кажутся сплошными, но применение приборов с большой разрешающей силой (отражательных решеток с большим числом штрихов) показало, что эти полосы распадаются на множество тесно расположенных отдельных спектральных линий.
В 1885 году швейцарский физик Бальмер, изучая спектр излучения атомов водорода, обнаружил, что длины волн четырех спектральных линий в видимой области спектра описываются формулой
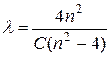 ,
, 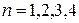 ,
,
где 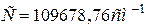
В дальнейшем были обнаружены спектральные линии, соответствующие номерам 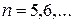 , которые лежали в инфракрасной области спектра. Данную группу спектральных линий стали называть серией Бальмера.
, которые лежали в инфракрасной области спектра. Данную группу спектральных линий стали называть серией Бальмера.
Ради удобства эту формулу стали записывать в перевернутом виде
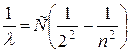 ,
,
а величину, обратную длине волны стали называть спектроскопическим квантовым числом.
До 1983г. положение спектральной линии в спектре характеризовалось только длиной волны 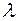 , хотя частота
, хотя частота 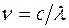 более удобна для выражения спектральных закономерностей. Причина этого заключалась в том, что спектральная аппаратура позволяла определять длину волны с точностью до седьмого десятичного знака, а измерение скорости света производилось с гораздо худшей точностью. Только после того, как на основе методов нелинейной оптики научились измерять частоту световых колебаний с точностью, превышающей точность измерения длины волны, генеральная конференция по мерам и весам в 1983г. приняла новое определение метра. Согласно этому определению скорость света в вакууме принимается равной
более удобна для выражения спектральных закономерностей. Причина этого заключалась в том, что спектральная аппаратура позволяла определять длину волны с точностью до седьмого десятичного знака, а измерение скорости света производилось с гораздо худшей точностью. Только после того, как на основе методов нелинейной оптики научились измерять частоту световых колебаний с точностью, превышающей точность измерения длины волны, генеральная конференция по мерам и весам в 1983г. приняла новое определение метра. Согласно этому определению скорость света в вакууме принимается равной
|
|
|
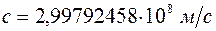 .
.
Метр же определяется через расстояние проходимое светом в вакууме за одну секунду. Это позволяет определять положение спектральной линии в спектре излучения частотой, что, как уже говорилось, более удобно для выражения спектральных закономерностей.
 2. Основным законом спектроскопии, установленным в 1908г. является комбинационный принцип Ритца. Он заключается в том, что все многообразие частот спектральных линий рассматриваемого атома можно получить путем попарных комбинаций гораздо меньшего числа величин, называемых спектральными термами. Частота спектральной линии выражается разностью двух термов
2. Основным законом спектроскопии, установленным в 1908г. является комбинационный принцип Ритца. Он заключается в том, что все многообразие частот спектральных линий рассматриваемого атома можно получить путем попарных комбинаций гораздо меньшего числа величин, называемых спектральными термами. Частота спектральной линии выражается разностью двух термов
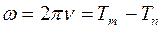 . (1)
. (1)
Термы имеют положительные значения и уменьшаются при увеличении номера терма (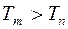 для
для 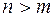 ). Условно термы можно изобразить в виде горизонтальных линий, а переходы между ними в виде вертикальных стрелок. На этой диаграмме вертикальная ось в определенном масштабе отражает величину терма.
). Условно термы можно изобразить в виде горизонтальных линий, а переходы между ними в виде вертикальных стрелок. На этой диаграмме вертикальная ось в определенном масштабе отражает величину терма.
Если фиксировать 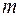 и придавать
и придавать 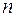 различные значения, начиная с
различные значения, начиная с 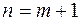 , то получится система линий, называемая спектральной серией. Совокупность всех серий составляет спектр рассматриваемого элемента.
, то получится система линий, называемая спектральной серией. Совокупность всех серий составляет спектр рассматриваемого элемента.
Если 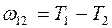 и
и 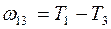 - две частоты спектральных линий одной и той же серии, то вычитая из второго равенства первое получим частоты спектральной линии, принадлежащей к серии с начальным термом
- две частоты спектральных линий одной и той же серии, то вычитая из второго равенства первое получим частоты спектральной линии, принадлежащей к серии с начальным термом 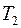
 .
.
Из комбинационного принципа следует, что разность частот двух спектральных линий одной серии дает частоту другой серии того же атома. Вообще говоря, такой линии в спектре может и не оказаться, так как на комбинации термов друг с другом накладываются некоторые ограничения, называемые правилами отбора.
|
|
|
Аналитические выражения для термов большинства атомов не известны. В некоторых случаях для термов можно записать эмпирические или полуэмпирические выражения. Исключение составляет простейший атом - атом водорода. Для атома водорода терм с высокой точностью определяется по формуле
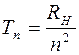 (
(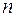 = 1, 2, 3,…), (2)
= 1, 2, 3,…), (2)
где постоянная Ридберга для атома водорода имеет численное значение
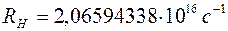 .
.
Для атома водорода частоты всех спектральных линий описываются формулой
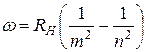 , где
, где 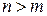 . (3)
. (3)
Для фиксированного значения 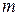 эта формула определяет частоты определенной серии линий. При
эта формула определяет частоты определенной серии линий. При 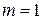 получаем серию Лаймана, при
получаем серию Лаймана, при 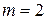 - серию Бальмера, при
- серию Бальмера, при 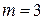 - серию Пашена и т.д.
- серию Пашена и т.д.
Серия Пашена
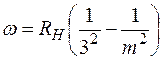 , где m = 4, 5, 6,….
, где m = 4, 5, 6,….
была предсказана Ритцем в 1908г. на основе комбинационного принципа и экспериментально обнаружена Пашеном в том же году в инфракрасной области спектра
Максимальная длина волны для серии Лаймана получается при 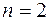
 .
.
Соответствующая линия называется резонансной линией водорода.
Максимальная частота (минимальная длина волны) в каждой серии получается при 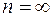 . Такая частота называется границей серии. Для серии Лаймана она равна
. Такая частота называется границей серии. Для серии Лаймана она равна 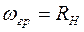 , для серии Бальмера -
, для серии Бальмера - 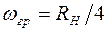 и т.д.
и т.д.
При приближении к границе серии спектральные линии сгущаются: разность длин волн между ними стремится к нулю; стремятся к нулю и интенсивности линий. За границей серии спектр становится сплошным. Эта закономерность проявляется не только у водорода, но и у других элементов. У них тоже существуют границы серий, за которыми следует сплошной спектр.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 2485; Нарушение авторских прав?; Мы поможем в написании вашей работы!