
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газовая среда
|
|
|
|
Растворами называются такие системы, в которых одно вещество равномерно распределено в среде другого или других веществ. Процесс растворения связан с различными взаимодействиями химического и кинетического характера между частицами растворенного вещества и растворителя.
Растворы и расплавы
Частицы, образующие раствор, могут быть атомами, молекулами или ионами. Атомные, молекулярные, ионные растворы (электролиты) называются истинными растворами. Если раствор не находится в состоянии молекулярной (атомной, ионной) дисперсности, то говорят о коллоидных растворах. И, наконец, более крупные частицы (агрегаты) составляют механические смеси.
При росте кристаллов из раствора важнейшей равновесной характеристикой становится растворимость, на которую оказывают влияние примеси. Это влияние затем распространяется на процесс кристаллизации и на свойства растущего кристалла.
Растворение – процесс химический – оно происходит при взаимодействии растворяемого вещества и растворителя и всегда сопровождается тепловыми, объемными и другими эффектами с возникновением в растворах группировок (в большей или меньшей степени неустойчивых во времени), состоящих из иона (Ме) растворенного вещества и окружающих ионов (молекул) растворителя.
В разных растворителях для одного и того же вещества наблюдается различный вид зависимости теплоты растворения (∆Н) от концентрации. Что заставляет говорить о различном механизме растворения.
Выращивание монокристаллов ведется только в метастабильной области вблизи кривой растворимости. По форме кривой растворимости определяют рациональное применение того или иного способа задания пересыщения.
|
|
|
Для подавляющего большинства веществ растворимость падает при снижении температуры (сегнетовая соль, квасцы, медный купорос, сахар). При понижении температуры растворы таких веществ становятся пересыщенными и отдают в кристаллическую фазу определенное количество вещества из каждого литра раствора. В солях, растворимость которых понижается с повышением температуры (сульфат лития, КСl), определенное количество вещества можно выделить в результате нагревания раствора. Веществам первой группы приписывают положительный температурный коэффициент растворимости (т.к.р.), веществам второй – отрицательный. Вещества с изменением т. к. р., близким к нулю, непригодны для «температурного» выращивания монокристаллов. Наиболее известный пример – поваренная соль. Пересыщение здесь вызывается пересыщением части растворителя, которое можно осуществить не только испарением, но и введением в раствор другого вещества, более растворимого, чем первое. Введение спирта в насыщенные водные растворы многих неорганических солей почти всегда приводит к образованию в массе раствора облака мелких кристаллов растворенных солей.
Жидкость, получающаяся при конгруэнтном (без разложения) плавлении чистого соединения, называется расплавом. Состав растущих из расплава кристаллов обычно одинаков с составом самой жидкости. Постоянная и максимально высокая для этого соединения температура кристаллизации равна или близка к температуре плавления этого соединения.
Для выращивания монокристаллов из расплава используются различные методы. В основе всех их лежит направленная кристаллизация расплава, при которой зарождение и рост кристалла при наличии переохлаждения ∆Т в расплаве осуществляются на одной фазовой границе и теплота от фронта кристаллизации отводится преимущественно в одном направлении. Это позволяет кристаллизовать расплав в виде одного монокристалла. Методы направленной кристаллизации можно разделить на три группы: расплавляют всю заготовку и затем кристаллизуют ее с одного конца; кристаллизацию расплавленной заготовки осуществляют путем вытягивания из нее монокристалла; последовательно в каждый момент времени расплавляют, а затем кристаллизуют только небольшую зону заготовки. Первую группу методов называют методами нормальной направленной кристаллизации, вторую – методами вытягивания кристаллов из расплава, третью – методами зонной плавки или зонной перекристаллизации.
|
|
|
Для газов, сред с неупорядоченным расположением материальных частиц, характерно повышенное стремление к переходу в кристаллическое (упорядоченное) состояние, так как при этом существенно изменяется энтальпия. В силу большого разряжения кристаллизация в газовой среде идет медленно и эти причины совместно благоприятствуют образованию чистых и совершенных монокристаллов.
Возможны два пути кристаллизации из паров (смесей газов):
1) по схеме пар 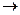 кристалл; 2) пар
кристалл; 2) пар 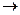 жидкость
жидкость 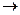 кристалл.
кристалл.
Первый путь особенно пригоден для веществ, которые переходят из твердого состояния в парообразное и обратно, минуя жидкую фазу (сухой лед – СО2, йод, нафталин). Для получения кристаллов из паров необходимо, чтобы при данном давлении температура эксперимента была выше той, при которой кристаллическое вещество находится в равновесии со своим паром, т.е. выше температуры сублимации.
В ряде случаев лучший результат дает кристаллизация через капельки жидкости (второй путь).
Наряду с сублимационными методами создания пересыщенных паров получили большое признание химические с использованием реакций восстановления или химических транспортных реакций.
Химическими транспортными называются обратимые реакции, при которые твердое или жидкое вещество А, взаимодействуя с газообразным веществом – транспортером В, образуют только газообразные продукты, которые после переноса в другую часть системы с измененными термодинамическими условиями равновесия распадаются с выделением кристаллического вещества А.
Возможность транспорта вещества А при помощи исследуемой реакции определяется величиной изобарного потенциала ∆G при изменении температуры от Т1 до Т2. Транспортной реакции не будет, если ∆G=0 или если ∆G очень велико.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!