
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Система MgO
|
|
|
|
Оксид магния MgO — единственное кислородное соединение магния. Это соединение не обнаруживает полиморфных превращений и существует в единственной кристаллической форме, называемой периклазом. Периклаз кристаллизуется в кубической системе (структурный тип NaCl) и относится к одному из самых тугоплавких оксидов (температура плавления 2800°С).
MgO является искусственным материалом, получаемым химической и термической обработкой природных соединений магния — магнезита MgCО3, доломита MgCО3-CaCО3, брусита Mg(0H)2, сжиганием металлического магния в кислороде, а также из морской воды. Свойства образующегося при этом продукта сильно зависят от вида сырьевого материала, способа получения и температуры термической обработки.
Слабообожженный MgO (каустический магнезит), возникающий в результате обжига при температурах менее 1000°С, обладает повышенной склонностью к гидратации и используется как вяжущее вещество. Обжиг при высокой температуре порядка 1700... 1750°С и выше приводит к спеканию MgO, сопровождаемому обычно процессом рекристаллизации, т.е. ростом зерен. Такой спеченный MgO представляет собой уже керамический материал.
Спеченный MgO как керамический материал обладает достаточно хорошей прочностью, высокими огнеупорностью и щелочестойкостью. Однако очень часто эти положительные качества керамики из MgO не могут быть реализованы на практике из-за совокупности некоторых отрицательных свойств.
К ним относятся: способность даже высокообожженного MgO гидра-тироваться не только в воде, но и на воздухе при обычном содержании водяных паров, низкая термостойкость, обусловленная большим коэффициентом термического расширения, и, наконец, повышенная летучесть MgO при высоких температурах, особенно в восстановительной среде и в вакууме (по некоторым данным, при испарении MgO происходит его диссоциация на элементы, причем главными составными частями в паре MgO являются газообразные Mg, О и О2 ). В связи с этим, несмотря на очень высокую температуру плавления (2800°С), практически область применения керамики из MgO в атмосферных условиях ограничивается температурой 2000... 2200°С, а в восстановительной среде и вакууме ~1700°С.
|
|
|
MgO в виде периклаза является важнейшей минералогической составляющей различных видов основных огнеупоров — магнезитовых, доломитовых, магнезито-хромитовых. Изделия из зернистых масс на основе MgO можно применять для футеровки высокотемпературных печей, работающих при температуре до 2000°С на воздухе или даже в парах щелочных металлов. Тигли из MgO используют для плавки высокочистых металлов (не восстанавливающих MgO). Получена также прозрачная керамика из MgO, обладающая достаточно высоким светопропусканием в видимой и инфракрасной областях спектра.
Система ZrО2
Диоксид циркония ZrО2, природной формой которого является минерал бадделеит,— единственный устойчивый оксид циркония, относящийся к соединениям с исключительно высокой тугоплавкостью (температура плавления чистого ZrО2 составляет 2715°С.
ZrО2 обладает достаточно сложным полиморфизмом, образуя три полиморфные модификации: моноклинную (α-ZrО2), тетрагональную (β-ZrО2) и кубическую, превращения между которыми можно изобразить следующей схемой:
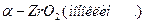

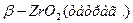
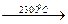
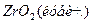
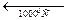
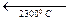
Все указанные превращения для чистого ZrО2 принадлежат к энантиотропным. До температуры порядка 1000... 1200°С устойчива низкотемпературная моноклинная форма ZrО2, которая выше этих температур переходит в тетрагональную разновидность ZrО2. Отношение длин осей а: с в тетрагональной форме составляет 1,018, т. е. приближается к отношению в кубической форме, поэтому тетрагональную модификацию иногда называют псевдокубической. Плотность моноклинной формы составляет 5,7-103, а тетрагональной 6,10 ∙ 103 кг/м3, поэтому превращение моноклинной формы в тетрагональную сопровождается уменьшением, а обратный переход при охлаждении — увеличением объема (примерно на 7,7%). При температуре ~2300°С тетрагональная форма переходит в высокотемпературную кубическую модификацию ZrО2. Кубическая и тетрагональная формы ZrО2 имеют структуру типа флюорита CaF2, а моноклинная — деформированную решетку, промежуточную между флюоритом и рутилом.
|
|
|
Объемные изменения при переходе ZrО2 (монокл.) ↔ ZrО2 (тетраг.) могут приводить на практике к разрушению изделий из ZrО2. Предотвращают этот переход с помощью кристаллохимической стабилизации ZrО2 за счет введения в его состав некоторых оксидов, образующих с ZrО2 твердые растворы замещения с кубической решеткой, устойчивые при всех температурах (в т. ч. и при нормальной). В качестве стабилизаторов используют оксиды, ионный радиус которых близок к ионному радиусу Zr4+, чаще всего CaO, MgO, Y2О3, а также ThО2, CeО2 и другие в количествах обычно 10... 15% (мол.).
Важное практическое значение при изготовлении изделий из ZrО2 имеет степень стабилизации ZrО2, определяющая устойчивость образующихся кубических твердых растворов. Недостаточная степень стабилизации может привести к распаду твердых растворов (дестабилизации), что сопровождается разрыхлением изделий, повышением их пористости и снижением прочности. Степень стабилизации зависит от вида стабилизатора, его количества, температуры обжига изделий, наличия примесей в ZrО2 и т. д. Например, твердые растворы, стабилизированные СаО и У2Оз, менее склонны к распаду, чем твердые растворы, стабилизированные MgO. Некоторые примеси, присутствующие в ZrО2, например TiО2, SiО2, Р2О5 и др., способные связывать стабилизатор, могут облегчать процесс дестабилизации. Минимальная температура обжига изделий из ZrО2, обеспечивающая полную стабилизацию, зависит от вида стабилизатора и степени частоты ZrО2. Обычно стабилизирующий обжиг изделий на основе чистого ZrО2 проводят при 1700... 1750°С, однако для полной стабилизации содержащего примеси технического ZrО2 температура должна быть повышена до~1900°С.
|
|
|
Система ZrО2 имеет большое значение для производства различных изделий и керамических масс на основе диоксида циркония, которые применяются в качестве твердых электролитов для работы при высоких температурах, высокотемпературных нагревателей, футеровки сталеразливочных ковшей, высокотемпературной теплоизоляции, защитных обмазок некоторых огнеупоров, защиты от коррозии и эрозии деталей реактивных двигателей, для изготовления тиглей для высокотемпературной плавки различных металлов, в качестве конструкционного материала и т. д.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1121; Нарушение авторских прав?; Мы поможем в написании вашей работы!