
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методические рекомендации. Гальванические элементы
|
|
|
|
План занятия
Гальванические элементы
Семинар 8. Электродные процессы.
4 часа
Цель семинара:
1.Изучить теорию возникновения скачка электродного потенциала на границе раздела фаз, устройство и работу гальванических элементов.
2. Научиться решать задачи на расчет электродных потенциалов и ЭДС гальванических элементов.
1. Изучение теоретических основ электрохимии.
2. Вывод уравнения Нернста.
3. Решение расчётных задач по теме семинара.
4. Подведение итогов семинара.
Основная литература
1. Зайцев О.С. Основы химической термодинамики. Изд. 3-е. М.: Химия, 2007. – с. 105-117.
2. Зимон А.Д. Физическая химия. Изд. 3-е. М.: Агар, 2006. – с. 123-130.
Дополнительная литература
1. Болдырев А.И. Физическая и коллоидная химия. – М.: Высшая школа, 2003.
2. Киреев В.А. Курс физической химии. – М.: Химия, 1995.
3. Физическая химия. / К.С. Краснов, Н.К. Воробъёв, И.Н. Годнев и др., под ред. К.С. Краснова. - М.: Высшая школа, 1995.
4. Чанг Р. Физическая химия с приложениями к биологическим системам. - М.: Мир,1990.
При подготовке к семинару необходимо получить четкое представление о механизме возникновения электродных потенциалов и о работе гальванического элемента вцелом. Уметь вывести уравнение Нерста, которое позволяет вычислить величину электродного потенциала в заданных условиях. Обратить внимание на химические реакции, которые протекают в различных гальванических элементах при их работе. Научиться составлять гальванические элементы пользуясь рядом напряжений и вычислять их ЭДС.
Вопросы для самоподготовки:
1. Что такое гальванический элемент? В каких местах и какие скачки потенциалов возникают в Г.Э.?
2. Объясните возникновение скачка потенциалов на границе металл/раствор.
|
|
|
3. Что такое электродный потенциал? От каких факторов зависит его величина?
4. Выведите и поясните уравнение Нернста, на основании которого можно вычислить величину электродных потенциалов в заданных условиях.
5. Что такое диффузный потенциал? Объясните механизм его возникновения. Напишите математическое выражение для величины диффузионного потенциала и поясните его.
6. Что такое мембранный потенциал? Как он возникает и каково его биологическое значение?
7. Как вычисляется ЭДС гальванического элемента? Почему при расчете ЭДС часто пренебрегают диффузионным потенциалом? В каких случаях им нельзя пренебрегать?
8. Как построить (собрать) гальванический элемент, чтобы диффузионный потенциал в нем практически отсутствовал?
9. Напишите уравнения реакций, протекающих на электродах и в цепи в целом, для следующих гальванических элементов:
а) Mg | MgSO4 || NiSO4 | Ni;
б) Zn | ZnCl2 || KClнасыщ., Hg2Cl2 | Hg;
в) Pt, H2 (p = 101,3 кПа) | HCl | Cl2 (p = 101,3 кПа), Pt;
г) Cd | CdSO4, Hg2SO4 | Hg
10. Составьте цепи, в которых идут следующие реакции:
а) CoSO4 + Zn = ZnSO4 + Co;
б) CuCl2 + 2Hg = Hg2Cl2 + Cu;
в)H2 + 1/2O2 = H2O
г) 2AgNO3 + H2 = 2HNO3 + 2Ag
Запишите уравнения процессов, протекающих на электродах.
11. Начертите схему прибора, применяемого для определения электродвижущей силы гальванического элемента, и поставьте стрелками направление тока. Выведите формулу, которая применяется для определения электродвижущей силы элемента.
12. Как устроен нормальный элемент? Какие реакции идут на электродах и во всей цепи? Для какой цепи он применяется?
13. Что такое стандартный водородный электрод? Напишите какая на нем идет реакция, если он является: а) положительным и б) отрицательным электродом в элементе. Для какой цепи он применяется?
14. Что такое каломельный электрод? Напишите, какая идет на нем реакция, если он является: а) положительным и б) отрицательным электродом в элементе. Для какой цели он применяется?
|
|
|
15. Каковы устройство и работа хлоросеребряного электрода? Для какой цели он применяется?
16. Как на опыте определяются потенциалы отдельных электродов? Разберите на примерах.
17. Что такое электрохимический ряд напряжения металлов? Как он составляется?
18. Что такое концентрационная цепь? Разберите на примере. Какие процессы протекают на электродах? За счет какого процесса возникает ток в этом элементе? Для какой цепи используются концентрационные элементы?
19. В чем сущность электрометрического метода определения рН?
20. Какие электроды применяются при определении рН электрометрическим методом? Напишите и поясните формулы, применяемые для определения величины рН.
21. Что такое хингидронный электрод? Какие процессы протекают в этом электроде? Почему он может применяться для определения рН.
22. Как устроен и работает стеклянный электрод? Для какой цели он применяется?
23. Какие электроды называются окислительно- восстановительными? Приведите примеры. Напишите и поясните математические выражения для потенциала окислительно–восстановительного электрода.
24. Напишите уравнения реакций, протекающих на электродах и во всей цепи в следующих гальванических элементах:
а) Pt | Sn2+, Sn4+ || Cr3+, Cr2O 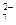 , H+ | Pt;
, H+ | Pt;
б) Pt | Fe2+, Fe3+ || Mn2+, MnO  , H+ | Pt
, H+ | Pt
25. Что такое коррозия металлов? В чем состоит сущность электрохимической коррозии металлов? Поясните на примере.
26. Изложите основные методы защиты металлов от коррозии.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 843; Нарушение авторских прав?; Мы поможем в написании вашей работы!