
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение количества воздуха необходимого для полного сгорания топлива
|
|
|
|
Расчет горения газообразного топлива
Дано: топливо природный газ
CH4=91,5%, CO2=0,6%, N2=4,2%, C2H6=2,3%, C4H10=1,1%, C3H8=0,2%, C2H8=0,1
Температура воздуха: tв=40 0С
Коэффициент избытка воздуха: α=1,05
Состав топлива:
CH4 + C2H6 + C4H10 + C3H8 + C2H8 + CO2 + N2 = 100 %.
91,5+2,3+1,1+0,2+0,1+0,6+4,2 =100
Количество кислорода необходимое для горения:
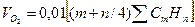 =
=
=0.01*(2*CH4+3.5*C2H6+5*C3H8+6.5*C4H10+4*C2H8)=0.01*(2*91,5+3.5*2,3+5*0,2+6.5*1,1+4*0,1)=2 м3/м3
Количество теоретически необходимого воздуха:
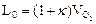 =4,76*2=9,5 м3/м3
=4,76*2=9,5 м3/м3
Действительное количество воздуха необходимого для горения:
Lα = αL0=1,05*9,5=9,98 м3/м3
1.2.2 Количество и состав продуктов горения (ПГ):
Объем RO2:
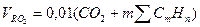 .=0.01*(CO2+CH4+2*C2H6+4*C4H10+3*C3H8+2*C2H8) =0.01*(0,6+91,5+2*2,3+4*1,1+3*0,2+2*0,1) =1,02 м3/м3
.=0.01*(CO2+CH4+2*C2H6+4*C4H10+3*C3H8+2*C2H8) =0.01*(0,6+91,5+2*2,3+4*1,1+3*0,2+2*0,1) =1,02 м3/м3
Водяной пар образуется при горении углеводородов, водорода и сероводорода. Тогда количество водяного пара в продуктах полного горения:
 .=0.01*(2*CH4+3*C2H6+5*C4H10+4*C3H8+4*C2H8)= 0.01*(2*91,5+3*2,3+5*1,1+4*0,2+4*0,1)=1,97 м3/м3
.=0.01*(2*CH4+3*C2H6+5*C4H10+4*C3H8+4*C2H8)= 0.01*(2*91,5+3*2,3+5*1,1+4*0,2+4*0,1)=1,97 м3/м3
Объем азота:
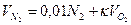 .=0,01*4,2+3,76*2=7,55 м3/м3
.=0,01*4,2+3,76*2=7,55 м3/м3
Объем избыточного кислорода:
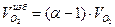 =0,05*2=0,1 м3/м3
=0,05*2=0,1 м3/м3
Объем избыточного азота:
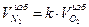 =3,76*0,1=0,38 м3/м3
=3,76*0,1=0,38 м3/м3
Суммарный объем азота:
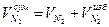 =7,55+0,38=7,92 м3/м3
=7,55+0,38=7,92 м3/м3
Теоретическое количество продуктов сгорания (дыма):
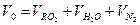 =1,02+1,97+7,55=10,53 м3/м3
=1,02+1,97+7,55=10,53 м3/м3
Общее количество продуктов сгорания (дыма):
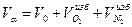 =10,53+0,1+0,38=11,01 м3/м3
=10,53+0,1+0,38=11,01 м3/м3
Состав продуктов сгорания (дыма):
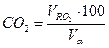 =(1,02*100)/11,01=9,26 %:
=(1,02*100)/11,01=9,26 %:
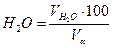 =(1,97*100)/11,01=17,86 %:
=(1,97*100)/11,01=17,86 %:
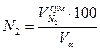 =(7,92*100)/11,01=71,97 %:
=(7,92*100)/11,01=71,97 %:
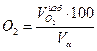 =(0,1*100)/11,01=0,91 %:
=(0,1*100)/11,01=0,91 %:
Плотность продуктов сгорания:
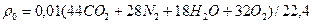 =0,01*(44*9,26+28*71,97+18*17,86+32*0,91)=1,24 кг/м3
=0,01*(44*9,26+28*71,97+18*17,86+32*0,91)=1,24 кг/м3
1.2.3 Определение температуры горения топлива:
Теплота сгорания газа:
 358*CH4+636*C2H6+913*C3H8+1185*C4H10+590*C2H8=35764,9 кДж/м3
358*CH4+636*C2H6+913*C3H8+1185*C4H10+590*C2H8=35764,9 кДж/м3
Химическая энтальпия продуктов сгорания:
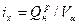 =35764,9/11,01=3249,28 кДж/м3
=35764,9/11,01=3249,28 кДж/м3
Энтальпия воздуха:
|
|
|
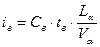 =1,3*40*(9,98/11,01)=47,11 кДж/м3
=1,3*40*(9,98/11,01)=47,11 кДж/м3
Энтальпия продуктов сгорания:
i = ix+iв=3249,28+47,11=3296,4 кДж/м3
Теоретическая температура сгорания:
1958,79 0С
Действительная температура сгорания:
tn=ηt=0,7*1958,79=1371,15 0С
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1056; Нарушение авторских прав?; Мы поможем в написании вашей работы!