
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ динамики коэффициента соотношения между темпами роста производительности труда и его оплатой. 2 страница
|
|
|
|
При растворении иода в щелочи получается смесь иодида и иодата.
Реакции:
2MI + 2H2O = 2MOH + H2 + I2 (электролиз)
2NaCl + 2H2O = 2NaOH + H2 + Cl2 (электролиз)
6NaOH + I2 = NaI + NaIO3 + 3H2O
Задача 3.
При взаимодействии металлов с очень разбавленной азотной кислотой возможно три варианта:
а) Me + HNO3 ® Me(NO3)x + NO
б) Me + HNO3 ® Me(NO3)x + N2
в) Me + HNO3 ® Me(NO3)x + NH4NO3
Реакции (а) и (б) относятся к случаю малоактивных металлов, а реакция (в) будет протекать в случае активных металлов.
В случаях (а) и (б) при прокаливании сухого остатка будет происходить разложение нитрата либо до оксида металла, кислорода и диоксида азота, либо до металла, кислорода и диоксида азота.
Me(NO3)x = MeOx/2 + xNO2 + x/4O2
Из 1 моль нитрата получается 1,25x моль газообразных продуктов.
Тогда получаем: 1,92: 22,4 = 0,0857 = 4 · 1,25 · х: М
М = 58,34х – таких металлов нет
Me(NO3)x = Mе + xNO2 + x/2O2
Из 1 моль нитрата получается 1,5x моль газообразных продуктов.
Тогда получаем: 0,0857 = 4 · 1,5 · х: М
М = 70,01х – таких металлов нет
В случае (в) сухой остаток будет смесью нитрата металла и нитрата аммония. При прокаливании нитрата такого металла он будет разлагаться на нитрит и кислород или на оксид металла и диоксид азота, а нитрат аммония - на азот, кислород и воду (N2O при данной температуре термически неустойчив). Рассмотрим первый вариант
Ме + 5x/4HNO3 = Me(NO3)x + x/8NH4NO3 + 3x/8H2O
Me(NO3)x = Me(NO2)x + x/2O2
2NH4NO3 = 2N2 + О2 + 4H2O
Таким образом, на 1 моль металла приходится 0,9375х моль газов.
0,0857 = 4 · 0,9375 · х: М
М = 43,76х. При х = 2 М = 87,52 г/моль, металл – стронций.
Задача 4.
Условием осуществления процесса получения металла из его оксида методом металлотермии является экзотермичность соответствующей реакции восстановления
xМg + M’Ox = xMgO + M’
Тепловой эффект этой реакции легко рассчитать по закону Гесса:
|
|
|
Q = xQобр(MgO) – Qобр(M’Ox)
Тогда получаем:
| Металл | Х | Q, кДж/моль | |
| Ca | -33 | Эндо | |
| Ga | 1,5 | -7 | Эндо |
| La | 1,5 | 5,5 | Экзо |
| Ti | Экзо | ||
| Zn | Экзо |
Таким образом, из приведенных металлов методом магнийтермии могут быть получены лантан, титан и цинк.
Препятствовать получению металла данным методом могут процессы образования твердых растворов и сплавов, снижающие чистоту продукта.
Задача 5.
Пусть M(Hal) = x г/моль, тогда по результатам анализа можно получить соотношение элементов в X-Hal:
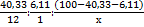 = 3,36: 6,11: 53,56/x = x/15,94: x/8,77: 1.
= 3,36: 6,11: 53,56/x = x/15,94: x/8,77: 1.
| Hal | M(Hal) = x, г/моль | Соотношение |
| F | 1,19: 2,17: 1 | |
| Cl | 35,5 | 2,23: 4,05:1 |
| Br | 5,02: 9,12: 1 | |
| I | 7,97: 14,48:1 |
По химическому смыслу подходит только вариант с бромом: C5H9Br (X – C5H10 – удовлетворяет формуле СnH2n, соответствующей алкенам или циклоалканам)
Исходя из этой формулы, получим теоретические значения: ω(С) = 40,29% и ω(Н) = 6,10%. Следовательно, Δ(C) = 100 · (40,33-40,29): 40,29 = 0,1%.
Δ(H) = 100 · (6,11-6,10): 6,10 = 0,16%.
Всего существует 12 изомерных углеводородов:
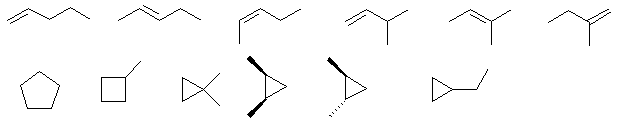
По 6 моногалогенпроизводных имеют пентен-1 и метилциклобутан:

По 3 моногалогенпроизводных имеют 2-метилбутена-2 и транс -1,2-диметилциклопропан:

2 моногалогенпроизводных имеет 1,1-диметилциклопропан:

Задача 6.
По схеме реакций получается:С6Н12 → С6H12-nBrn →nAgBr
Числа моль циклогексана и бромида серебра равны, соответственно: 10,5:84,18=0,1247 и 35,10:187,77=0,1869, а их отношение: 0,1869:0,1247=1,50. Это означает, что продукт представляет собой смесь 1:1 по молям моно- и дибромциклогексана.
Задача 1.
NH4NO3 = N2O + 2H2O
CH4 = C + 2H2 или
2CH4 = C2Н2 + 3H2
2BaO2 = 2BaO + O2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Задача 2.
Бром содержится в морской воде в виде бромид-ионов и легко может быть вытеснен хлором (отделить от иода можно путем охлаждения и последующего выделения кристаллов иода). Хлор для этих целей легко получить электролизом раствора хлорида калия, встречающегося в природе в виде минерала сильвина. При последующем растворении брома в щелочи получается смесь бромида и бромата.
|
|
|
Реакции:
2KCl + 2H2O = 2KOH + H2 + Cl2 (электролиз)
Cl2 + 2NaBr = 2NaCl + Br2
6KOH + Br2 = KBr + KBrO3 + 3H2O
Задача 3.
При взаимодействии металлов с очень разбавленной азотной кислотой возможно три варианта:
а) Me + HNO3 ® Me(NO3)x + NO
б) Me + HNO3 ® Me(NO3)x + N2
в) Me + HNO3 ® Me(NO3)x + NH4NO3
Реакции (а) и (б) относятся к случаю малоактивных металлов, а реакция (в) будет протекать в случае активных металлов.
В случаях (а) и (б) при прокаливании сухого остатка будет происходить разложение нитрата либо до оксида металла, кислорода и диоксида азота, либо до металла, кислорода и диоксида азота.
Me(NO3)x = MeOx/2 + xNO2 + x/4O2
Из 1 моль нитрата получается 1,25x моль газообразных продуктов.
Тогда получаем: 1,53: 22,4 = 0,0683 = 5 · 1,25 · х: М
М = 91,5х – таких металлов нет
Me(NO3)x = Mе + xNO2 + x/2O2
Из 1 моль нитрата получается 1,5x моль газообразных продуктов.
Тогда получаем: 0,0683 = 5 · 1,5 · х: М
М = 109,81х – таких металлов нет
В случае (в) сухой остаток будет смесью нитрата металла и нитрата аммония. При прокаливании нитрата такого металла он будет разлагаться на нитрит и кислород или на оксид металла и диоксид азота, а нитрат аммония - на азот, кислород и воду (N2O при данной температуре термически неустойчив). Рассмотрим первый вариант
Ме + 5x/4HNO3 = Me(NO3)x + x/8NH4NO3 + 3x/8H2O
Me(NO3)x = Me(NO2)x + x/2O2
2NH4NO3 = 2N2 + О2 + 4H2O
Таким образом, на 1 моль металла приходится 0,9375х моль газов.
0,0683 = 5 · 0,9375 · х: М
М = 68,63х
При х = 2 М = 137,26 г/моль, металл – барий.
Задача 4.
Условием осуществления процесса получения металла из его оксида методом металлотермии является экзотермичность соответствующей реакции восстановления
xAl + 1,5M’Ox = x/2Al2O3 + 1,5M’
Тепловой эффект этой реакции легко рассчитать по закону Гесса:
Q = x/2Qобр(Al2O3) – 1,5Qобр(M’Ox)
Тогда получаем:
| Металл | Х | Q, кДж/моль | |
| Mg | -65 | эндо | |
| Sn | 804,5 | Экзо | |
| In | 1,5 | Экзо | |
| Cr | 1,5 | 267,5 | Экзо |
| Cd | экзо |
Таким образом, из приведенных металлов методом алюминотермии могут быть получены олово, индий, хром и кадмий.
Препятствовать получению металла данным методом могут процессы образования твердых растворов и сплавов, снижающие чистоту продукта.
Задача 5.
Пусть M(Hal) = x г/моль, тогда по результатам анализа можно получить соотношение элементов в X-Hal:
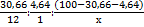 = 2,56: 4,64: 64,70/x = x/25,27: x/13,94: 1.
= 2,56: 4,64: 64,70/x = x/25,27: x/13,94: 1.
| Hal | M(Hal) = x, г/моль | Соотношение |
| F | 0,75: 1,36: 1 | |
| Cl | 35,5 | 1,40: 2,55:1 |
| Br | 3,17: 5,74: 1 | |
| I | 5,03: 9,11:1 |
По химическому смыслу подходит только вариант с иодом: C5H9I (X – C5H10 – удовлетворяет формуле СnH2n, соответствующей алкенам или циклоалканам)
|
|
|
Исходя из этой формулы, получим теоретические значения: ω(С) = 30,63% и ω(Н) = 4,64%. Следовательно, Δ(C) = 100 · (30,66-30,63):30,63 = 0,1%.
Δ(H) = 100 · (4,64-4,64):4,64 = 0,0%. (Водород определен точно).
Всего существует 12 изомерных углеводородов:

По 6 моногалогенпроизводных имеют пентен-1 и метилциклобутан:
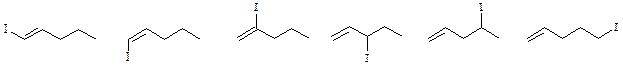

По 3 моногалогенпроизводных имеют 2-метилбутена-2 и транс -1,2-диметилциклопропан:

2 моногалогенпроизводных имеет 1,1-диметилциклопропан:
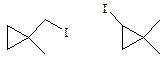
Задача 6.
По схеме реакций получается:С6Н12 → С6H12-nCln →nAgCl
Числа моль циклогексана и хлорида серебра равны, соответственно: 5,5:84,18=0,0653 и 14:143,32=0,0977, а их отношение: 0,1869:0,1247=1,50. Это означает, что продукт представляет собой смесь 1:1 по молям моно- и дихлорциклогексана.
Задача 1.
Один из возможных вариантов:
С + O2 = CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CaCl2 = 2NaCl + CaCO3
CaCO3 + 4C = CaC2 + 3CO
CaC2 + 2H2O = Ca(OH)2 + H2C2
Задача 2.
Из бинарных соединений кальция при взаимодействии с водой газ будут образовывать гидрид, карбид, нитрид, фосфид. Соответственно, продуктами взаимодействия с водой могут быть водород, ацетилен, аммиак и фосфин. Поскольку относительная плотность выделяющегося при взаимодействии с селенистой кислотой газа равна 0,85, молярная масса этого газа составляет М = 0,85 · 40 = 34 г/моль. Данному условию отвечает фосфин, РН3.
По-видимому, второй газ поглощается кислотой. Из указанных выше вариантов основные свойства проявляет только аммиак. Следовательно, исходная смесь состояла из фосфида и нитрида кальция.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3
Ca3P2 + 3H2SeO3 = 3CaSeO3 + 2PH3
Ca3N2 + 4H2SeO3 = 3CaSeO3 + (NH4)2SeO3
Определим мольное соотношение нитрида и фосфида кальция. Пусть мольная доля аммиака в смеси газообразных продуктов составляет х. Тогда:
17х + 34·(1-х) = 0.65·40 = 26
Х = 0,47, т.е., на 0,47 моль нитрида кальция приходится 0,53 моль фосфида.
Тогда массовая доля нитрида кальция составит
0,47 · 148:(0,47 · 148 + 0,53 · 182) = 41,9%
|
|
|
Массовая доля фосфида кальция – 58,1%.
Задача 3.
При электролизе будет протекать процесс:
2HCl = H2 + Cl2
Полученный хлор будет взаимодействовать с гидроксидом бария:
2Ba(OH)2 + 2Cl2 = BaCl2 + Ba(ClO)2 + 2H2O
6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6H2O
Следует отметить, что массы образующихся солей в обоих случаях одинаковы.
В исходном растворе хлороводорода присутствовало 250 · 1,05 · 0,10: 36,5 = 0,72 моль HCl. Для получения 1 моль хлора требуется 96500 · 2 = 193000 Кл. По условию задачи через раствор пропустили 5 000 Кл электричества, следовательно, хлороводород в недостатке. В результате электролиза получилось 5000: 193000 = 0,026 моль хлора.
В баритовой воде присутствовало 300 · 0,05: 171,3 = 0,088 моль гидроксида бария. По-видимому, хлор взят в недостатке. Тогда в результате реакции получится 0,044 моль хлорида бария и 0,044 моль гипохлорита бария или 0,0073 моль хлорида и 0,0367 моль хлората или смесь хлорида, хлората и гипохлорита. Также останется непрореагировавший гидроксид бария в количестве 0,036 моль
Масса продукта при этом составит
m = 0,044 · 208,3 + 0,044 · 240,3 + 0,036 · 171,3 = 25,91 г
Задача 4.
Запишем кинетическое уравнение реакции.
V = k[CH3CHO]2
Повышение давления равнозначно увеличению концентрации газообразных веществ. Следовательно, концентрация увеличилась в 1,52: 1,1 = 1,382 раза.
V’ = k[CH3CHO]’2 = k∙1,3822[CH3CHO]2 = 1,91V
По условию также уменьшили температуру на 10 oС. По правилу Вант-Гоффа:
V’ = V∙gDT/10 = V∙2,2-1 = 0,4545V
В результате скорость реакции увеличится в 1,91∙0,4545 = 0,87 раза (< 1). Т.е. скорость реакции уменьшится в 1: 0,87 = 1,15 раза.
Схема катализа:
СН3СНО + I2 → СН3I + НI + СО
СН3I + НI → СН4 + I2
Ответ: скорость реакции уменьшится в 1,15 раза.
Задача 5.
Кислотная дегидратация спиртов приводит к образованию алкенов или простых эфиров (только в случае первичных спиртов). Рассмотрим возможные случаи образования продуктов в температурном интервале нагревания до 140 oС (тогда исключается возможность образования алкенов из первичных спиртов):
1) первичный (1)/первичный (2) – эфир (1), эфир(2), эфир (3) – продукт перекрестной дегидратации: образуется 3 продукта, противоречит условию;
2) вторичный (1)/ вторичный (2) – алкен (1), алкен (2); для случаев третичный (1)/третичный (2) и вторичный/третичный аналогично: массовая доля углерода 12n: 14n = 6/7 есть величина постоянная для любого алкена (CnH2n), противоречит условию;
3) первичный/ вторичный – эфир, алкен; для случая первичный/третичный аналогично – удовлетворяет условию.
Легко показать, что массовая доля углерода в любом эфире всегда меньше, чем в алкене. Общая формула эфира CnH2n+2O, ω(C) = 12n: (14n + 18) = 6/7 – 0,119. Решая это уравнение, получим n = 8. В спирте число атомов углерода в 2 раза меньше. Таким образом, один из спиртов н-C4H9OH.
ω(C в н-C4H9OH) = 100∙12∙4:74 = 64,9%, тогда ω(C в CmH2m + 2O) = (64,9 ± 4,9)% = 100∙12m:(14m + 18). Решая два уравнения, получим, m = 5,5 и m = 3. m должно быть натуральным числом, т.е. m = 3. Второй спирт – i-C3H7OH.
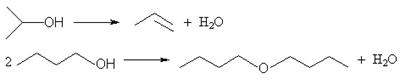
Задача 6.
Пусть Х – доля минорного компонента. По выражению для константы равновесия: 0,25=Х:(1-Х), Х=0,2, т.е 20% и 80%. Наиболее термодинамически стабилен 2-хлорпропан, он будет в избытке.
Одним из удобных способов синтеза является следующий:
CaC2 + 2H2O = HC≡CH + Ca(OH)2
Al4C3 + 12HCl = 3CH4 + 4AlCl3
CH4 + Br2 = CH3Br
HC≡CH + NaNH2 = HC≡CNa + NH3 (вместо NaNH2 можно использовать Na)
HC≡CNa + CH3Br = HC≡CCH3 + NaBr
HC≡CCH3 + H2 = H2C=CHCH3 (реакция идет в присутствии каталитически активного Pd)
H2C=CHCH3 + HCl = H3CCHClCH3
Однако возможны и другие пути синтеза.
Задача 1.
Один из возможных вариантов:
С + O2 = CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + 3C = CaC2 + 3CO
CaC2 + 2H2O = Ca(OH)2 + H2C2
H2C2 + 2HCl = CH3CHCl2
Задача 2.
Из бинарных соединений натрия при взаимодействии с водой газ будут образовывать гидрид, карбид, нитрид, фосфид. Соответственно, продуктами взаимодействия с водой могут быть водород, ацетилен, аммиак и фосфин. Поскольку относительная плотность выделяющегося при взаимодействии с водой газа равна 1,30, молярная масса этого газа составляет М = 1,30 · 20 = 26 г/моль. Данному условию отвечает ацетилен, С2Н2.
По-видимому, второй газ поглощается кислотой. Из указанных выше вариантов основные свойства проявляет только аммиак. Следовательно, исходная смесь состояла из карбида и нитрида натрия.
Na3N + 3H2O = 3NaOH + NH3
Na2C2 + 2H2O = 2NaOH + C2H2
2Na3N + 4H3PO3 = 3Na2HPO3 + (NH4)2HPO3
Na2C2 + H3PO3 = Na2HPO3 + C2H2
Определим мольное соотношение нитрида и карбида натрия. Пусть мольная доля аммиака в смеси газообразных продуктов составляет х. Тогда:
17х +26 · (1-х) = 1,00 · 20 = 20
Х = 2/3, т.е., на 2/3 моль нитрида натрия приходится 1/3 моль карбида.
Тогда массовая доля нитрида натрия составит
2/3 · 83: (2/3 · 83 + 1/3 · 70) = 70,3%
Массовая доля карбида натрия – 29,7%.
Задача 3.
При электролизе будет протекать процесс:
2HBr = H2 + Br2
Полученный бром будет взаимодействовать с раствором поташа:
3K2CO3 + Br2 = 5KBr + KBrO3 + 3CO2
В исходном растворе хлороводорода присутствовало 200 · 1,15 · 0,15: 81 = 0,426 моль HBr. Для получения 1 моль брома требуется 96500 · 2 = 193000 Кл. По условию задачи через раствор пропустили 7 000 Кл электричества, следовательно, бромоводород в недостатке. В результате электролиза получилось 7000: 193000 = 0,036 моль брома.
В растворе поташа присутствовало 200 · 0,08: 138 = 0,116 моль карбоната калия. По-видимому, бром взят в недостатке. Тогда в результате реакции получится 0,18 моль бромида калия и 0,036 моль бромата калия, а также останется 0,01 моль карбоната калия.
Масса сухого остатка составит
m = 0,18 · 110 + 0,036 · 167 + 0,01 · 138 = 27,192 г
Задача 4.
Запишем кинетическое уравнение реакции.
V = k[CH3CHO]2
Понижение давления равнозначно уменьшению концентрации газообразных веществ. Следовательно, концентрация стала равна (0,72:1,5)[CH3CHO] = 0,48[CH3CHO].
V’ = k[CH3CHO]’2 = k∙0,482[CH3CHO]2 = 0,2304V
По условию также увеличили температуру на 20 oС. По правилу Вант-Гоффа:
V’ = V∙gDT/10 = V∙2,22 = 4,84V
В результате скорость реакции увеличится в 0,2304∙4,84 = 1,12 раза.
Схема катализа:
СН3СНО + I2 → СН3I + НI + СО
СН3I + НI → СН4 + I2
Ответ: скорость реакции увеличится в 1,12 раза.
Задача 5.
Кислотная дегидратация спиртов приводит к образованию алкенов или простых эфиров (только в случае первичных спиртов). Рассмотрим возможные случаи образования продуктов в температурном интервале нагревания до 140 oС (тогда исключается возможность образования алкенов из первичных спиртов):
1) первичный (1)/первичный (2) – эфир (1), эфир(2), эфир (3) – продукт перекрестной дегидратации: образуется 3 продукта, противоречит условию;
2) вторичный (1)/ вторичный (2) – алкен (1), алкен (2); для случаев третичный (1)/третичный (2) и вторичный/третичный аналогично: массовая доля углерода 12n: 14n = 6/7 есть величина постоянная для любого алкена (CnH2n), противоречит условию;
3) первичный/ вторичный – эфир, алкен; для случая первичный/третичный аналогично – удовлетворяет условию.
Легко показать, что массовая доля углерода в любом эфире всегда меньше, чем в алкене. Общая формула эфира CnH2n+2O, ω(C) = 12n: (14n + 18) = 6/7 – 0,151. Решая это уравнение, получим n = 6. В спирте число атомов углерода в 2 раза меньше. Таким образом, один из спиртов н-C3H7OH.
ω(C в н-C3H7OH) = 100∙12∙3: 60 = 60%, тогда ω(C в CmH2m + 2O) = (60 ± 4,9)% = 100∙12m: (14m + 18). Решая два уравнения, получим, m = 2,3 и m = 4. m должно быть натуральным числом, т.е. m = 4. Второй спирт – t-C4H9OH или i-C4H9OH.
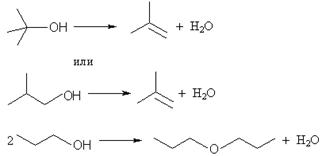
Задача 6.
Пусть Х – доля минорного компонента. По выражению для константы равновесия: 0,11=Х: (1-Х), Х=0,099, т.е 9,9% и 90,1%. Наиболее термодинамически стабилен 2-бромпропан, он будет в избытке.
Одним из удобных способов синтеза является следующий:
CaC2 + 2H2O = HC≡CH + Ca(OH)2
Al4C3 + 12HCl = 3CH4 + 4AlCl3
CH4 + Br2 = CH3Br
HC≡CH + NaNH2 = HC≡CNa + NH3 (вместо NaNH2 можно использовать Na)
HC≡CNa + CH3Br = HC≡CCH3 + NaBr
HC≡CCH3 + H2 = H2C=CHCH3 (реакция идет в присутствии каталитически активного Pd)
H2C=CHCH3 + HBr = H3CCHBrCH3
Однако возможны и другие пути синтеза.
Производительность труда характеризует степень интенсивности использования трудовых ресурсов на предприятии. Она показывает, сколько произведено продукции (работ) одним работником за единицу отработанного времени (год, месяц, день, час). Для оценки уровня производительности труда применяется система обобщающих, частных и вспомогательных показателей.
К обобщающим показателям относятся:
· производство валовой продукции сельскохозяйственного назначения на среднегодового работника, занятого в сельскохозяйственном производстве (с учетом обслуживающего и управленческого персонала);
· производство валовой продукции на 1 человеко-день;
· производство продукции на 1 человеко-час.
·Эти показатели рассчитываются и анализируются в целом по хозяйству, а также по растениеводству и животноводству.
В процессе анализа нужно изучить динамику данных показателей, выполнение плана по их уровню, провести межхозяйственный сравнительный анализ и выяснить причины их изменения.
Расчет влияния данных факторов производится одним из способов детерминированного факторного анализа.
Среднечасовая заработная плата, зависит от уровня интенсивности труда, пересмотра норм выработки и расценок, изменения разрядов работ и тарифных ставок, разных доплат и премий. Эти факторы могут быть установлены по данным бухгалтерского учета и статистической отчетности по труду.
В процессе анализа следует установить также соответствие между темпами роста средней заработной платы и производительностью труда. Для расширенного воспроизводства, получения необходимой прибыли и рентабельности нужно, чтобы темпы роста производительности труда опережали темпы роста его оплаты. Если этот принцип не соблюдается, то происходят перерасход фонда зарплаты, повышение себестоимости продукции и уменьшение суммы прибыли.
Изменение среднего заработка работающих за тот или иной отрезок времени (год, месяц, день, час) характеризуется его индексом (IЗП), который определяется отношением средней зарплаты за отчетный период к средней зарплате в базисном периоде. Аналогичным образом рассчитывается индекс производительности труда (IГВ):
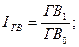
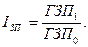
Для определения суммы экономии (-Э) или перерасхода (+Э) фонда зарплаты в связи с изменением соотношений между темпами роста производительности труда и его оплаты можно использовать следующую формулу:
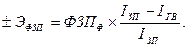
Для оценки эффективности использования средств на оплату труда необходимо применять такие показатели, как объем производства продукции в действующих ценах, сумма выручки и прибыли на рубль зарплаты и др. В процессе анализа следует изучить динамику этих показателей, выполнение плана по их уровню. Очень полезным будет межхозяйственный сравнительный анализ, который покажет, какое предприятие работает более эффективно.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 299; Нарушение авторских прав?; Мы поможем в написании вашей работы!