
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи, що використовуються для підвищення чутливості ПППР датчика біомолекул
|
|
|
|
По-перше, всі загальні речі з пит. Методи, що використовуються для покращення умов збудження та розповсюдження ППП). Крім формування самоорганізованого шару молекул на поверхні плівки з метою захисту поверхні металу, де розповсюджуються ПП, можемо модифікувати поверхню для більш ефективного використання згасаючого поля ПП.
Загасаюче електричне поле поверхневого плазмону проникає на певну відстань в середовище, що контактує з поверхнею металу, причому для z – компоненти поля 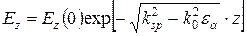 , (5.1) де k0 = w / c. Залежність для Ez компоненти загасаючої хвилі приблизно становить:
, (5.1) де k0 = w / c. Залежність для Ez компоненти загасаючої хвилі приблизно становить: 
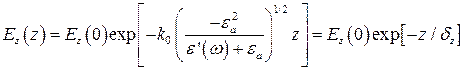 (5.2). Якщо підставити діелектричні констати золота e¢(w) = -13.5 та води ea = 1.77 (при l= 670 нм) в рівняння (5.2), то отримаємо типову глибину проникання для загасаючого поля плазмону в середовище над металом dz = 200 нм.
(5.2). Якщо підставити діелектричні констати золота e¢(w) = -13.5 та води ea = 1.77 (при l= 670 нм) в рівняння (5.2), то отримаємо типову глибину проникання для загасаючого поля плазмону в середовище над металом dz = 200 нм.
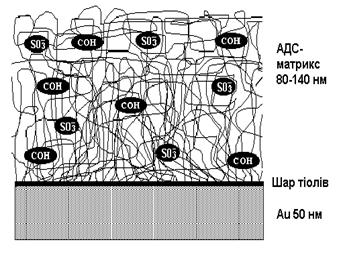 Для ефективного використання простору, в якому поширюється чутлива до змін на поверхні сенсора загасаюча хвиля поверхневого плазмону, та підвищення чутливості сенсора, досліджувані біомолекули часто приєднують не до плоскої поверхні, а до гнучких полімерних ланцюгів, попередньо іммобілізованих на ній. Такий підхід надає можливість іммобілізувати на сенсорній платівці кількість молекул, еквівалентну кільком щільно упакованим шарам, зберігаючи при цьому їх доступність для взаємодії з іншими біомолекулами. Найбільш поширена подібна полімерна матрична структура (далі – матрикс) формується за методом провідного виробника ППР-спектрометрів («Biacore AB», Швеція). Він виглядає досить складним для застосування його у повсякденній практиці користувачем метода ППР і передбачає формування на поверхні золота моношару омега-меркапто-гексадеканолу, його активацію епіхлоргідрином, ковалентне приєднання декстрану до “активованої поверхні”, перетворення іммобілізованого декстрану на карбоксиметил (КМ) -декстран, карбоксильні групи якого можна використати для іммобілізації білка — об’єкта досліджень Проте відомо, що КМ-декстрановий матрикс не є оптимальним для білків з низькою рІ, оскільки іммобілізація в матриксу однойменно з ним заряджених білків вимагає значної додаткової модифікації матриксу.
Для ефективного використання простору, в якому поширюється чутлива до змін на поверхні сенсора загасаюча хвиля поверхневого плазмону, та підвищення чутливості сенсора, досліджувані біомолекули часто приєднують не до плоскої поверхні, а до гнучких полімерних ланцюгів, попередньо іммобілізованих на ній. Такий підхід надає можливість іммобілізувати на сенсорній платівці кількість молекул, еквівалентну кільком щільно упакованим шарам, зберігаючи при цьому їх доступність для взаємодії з іншими біомолекулами. Найбільш поширена подібна полімерна матрична структура (далі – матрикс) формується за методом провідного виробника ППР-спектрометрів («Biacore AB», Швеція). Він виглядає досить складним для застосування його у повсякденній практиці користувачем метода ППР і передбачає формування на поверхні золота моношару омега-меркапто-гексадеканолу, його активацію епіхлоргідрином, ковалентне приєднання декстрану до “активованої поверхні”, перетворення іммобілізованого декстрану на карбоксиметил (КМ) -декстран, карбоксильні групи якого можна використати для іммобілізації білка — об’єкта досліджень Проте відомо, що КМ-декстрановий матрикс не є оптимальним для білків з низькою рІ, оскільки іммобілізація в матриксу однойменно з ним заряджених білків вимагає значної додаткової модифікації матриксу.
|
|
|
Інший метод формування матриксу полягає у використанні для іммобілізації білків на поверхні золота полімерні похідні поліметакроїліл-хлориду. Але даний метод дозволив іммобілізувати лише моношар білка, тобто не забезпечив однієї з переваг полімерних матриксів – збільшення кількості іммобілізованих біомолекул. Методика синтезу цих полімерів та приєднання їх до поверхні золота також здається досить складною. Тому постала задача розробити простіший та більш універсальний метод модифікації золотої поверхні для іммобілізації на ній білків та інших біологічних об’єктів. Найтиповішими об’єктами, для вивчення яких застосовують метод ППР, є білки. Необхідною умовою застосування методу ППР є іммобілізація однієї з біомолекул, що взаємодіють, на металевій (звичайно золотій) плівці, експонованій у досліджуваний розчин. Іммобілізація шляхом безпосередньої адсорбції на золото в багатьох випадках спричиняє неконтрольовані зміни просторової структури білка (денатурації), які призводять до втрати ним біологічної активності. Отже, поверхню золота 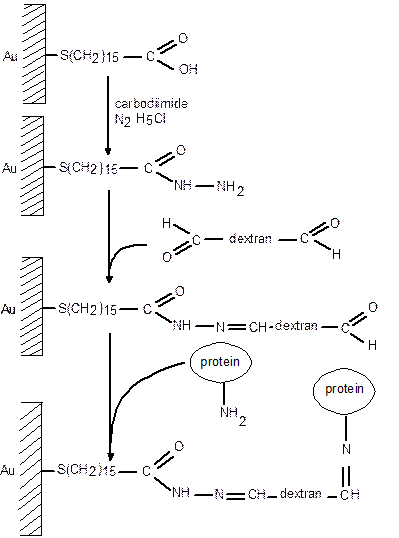 необхідно ізолювати від прямого контакту з білками - об’єктами дослідження. Відомо, що SH-групи, на відміну від більшості інших функціональних груп, взаємодіють із золотом, тому саме SH-вмісні сполуки використовують для створення зв’язуючого шару на поверхні золота. Як ми згадували на попередній лекції, найчастіше з цією метою використовують аліфатичні тіоли з досить довгими (n>=10) нерозгалуженими ланцюгами. Такі сполуки (або їх похідні з різноманітними функціональними групами на кінці метиленового ланцюга) спонтанно формують на поверхні золота досить стійкі впорядковані моношари, в яких атом сірки зв’язаний із золотом, а щільно упаковані аліфатичні ланцюги розташовані під однаковим кутом до поверхні. Моношар стабілізований численними міжланцюго-вими ван-дер-Ваальсовими взаємодіями. Розглянемо підхід, що базується на використанні 16-меркапто-гексадеканової кислоти (16-МГДК). Моношари омега-меркапто-карбонових кислот набули широкого застосування для хімічної модифікації поверхні золота при розробці хімічних та біосенсорів наприклад, чутливого елемента ППР-спектрометра, та електрода ємнісного імуносенсора. Орієнтовані в розчин карбоксильні групи моношару 16-МГДК можна використовувати для іммобілізації досліджуваних білків. Модифікацію карбоксильних груп моношару 16-МГДК здійснюють гідразином, одержуючи змішаний моношар 16-МГДК та її гідразиду. Остання сполука може реагувати з альдегідними групами. Гідразиди мають рК<4, що надає їм суттєву перевагу порівняно з первинними аміногрупами з точки зору іммобілізації біомолекул через їх альдегідні групи, оскільки реакція гідразиду з альдегідною групою може ефективно відбуватись за кислих рН, за яких первинні аміногрупи майже повністю протоновані, і відповідно не мають властивостей, необхідних для реакції з альдегідними групами. Для створення полімерного матриксу було обрано альдегідні похідні полісахаридів, одержані методом перйодатного окислення. Альдегідні похідні полісахаридів можна легко іммобілізувати на поверхні, що несе гідразидні групи, а до іммобілізованих похідних полісахаридів можна приєднати біомолекули, що містять аміногрупи, використовуючи альдегідні групи полісахаридів. Негативний заряд карбоксиметил-декстрану є його перевагою у випадках, коли іммобілізацію здійснюють за рН нижче ізоелектричної точки даного білка, оскільки електростатичне притягування молекул білка до матриксу сприяє його накопиченню в об’ємі, що прилягає до матриксу. Але для білків з низькою ізоелектричною точкою цей матрикс виявляється малопридатним, а зменшення вмісту карбоксильних груп означає зменшення кількості активних груп, через які відбувається іммобілізація. В матриксі, сформованому з перйодат-окисленого полісахариду, іммобілізація відбувається через незаряджені альдегідні групи, але в тих випадках, коли негативний заряд матриксу є бажаним, його можна одержати, використовуючи перйодат-окислений декстран-сульфат замість перйодат-окисленого декстрану. Додатковою перевагою обраного підходу є зменшення вартості реактивів, що використовуються, та їх більша доступність.
необхідно ізолювати від прямого контакту з білками - об’єктами дослідження. Відомо, що SH-групи, на відміну від більшості інших функціональних груп, взаємодіють із золотом, тому саме SH-вмісні сполуки використовують для створення зв’язуючого шару на поверхні золота. Як ми згадували на попередній лекції, найчастіше з цією метою використовують аліфатичні тіоли з досить довгими (n>=10) нерозгалуженими ланцюгами. Такі сполуки (або їх похідні з різноманітними функціональними групами на кінці метиленового ланцюга) спонтанно формують на поверхні золота досить стійкі впорядковані моношари, в яких атом сірки зв’язаний із золотом, а щільно упаковані аліфатичні ланцюги розташовані під однаковим кутом до поверхні. Моношар стабілізований численними міжланцюго-вими ван-дер-Ваальсовими взаємодіями. Розглянемо підхід, що базується на використанні 16-меркапто-гексадеканової кислоти (16-МГДК). Моношари омега-меркапто-карбонових кислот набули широкого застосування для хімічної модифікації поверхні золота при розробці хімічних та біосенсорів наприклад, чутливого елемента ППР-спектрометра, та електрода ємнісного імуносенсора. Орієнтовані в розчин карбоксильні групи моношару 16-МГДК можна використовувати для іммобілізації досліджуваних білків. Модифікацію карбоксильних груп моношару 16-МГДК здійснюють гідразином, одержуючи змішаний моношар 16-МГДК та її гідразиду. Остання сполука може реагувати з альдегідними групами. Гідразиди мають рК<4, що надає їм суттєву перевагу порівняно з первинними аміногрупами з точки зору іммобілізації біомолекул через їх альдегідні групи, оскільки реакція гідразиду з альдегідною групою може ефективно відбуватись за кислих рН, за яких первинні аміногрупи майже повністю протоновані, і відповідно не мають властивостей, необхідних для реакції з альдегідними групами. Для створення полімерного матриксу було обрано альдегідні похідні полісахаридів, одержані методом перйодатного окислення. Альдегідні похідні полісахаридів можна легко іммобілізувати на поверхні, що несе гідразидні групи, а до іммобілізованих похідних полісахаридів можна приєднати біомолекули, що містять аміногрупи, використовуючи альдегідні групи полісахаридів. Негативний заряд карбоксиметил-декстрану є його перевагою у випадках, коли іммобілізацію здійснюють за рН нижче ізоелектричної точки даного білка, оскільки електростатичне притягування молекул білка до матриксу сприяє його накопиченню в об’ємі, що прилягає до матриксу. Але для білків з низькою ізоелектричною точкою цей матрикс виявляється малопридатним, а зменшення вмісту карбоксильних груп означає зменшення кількості активних груп, через які відбувається іммобілізація. В матриксі, сформованому з перйодат-окисленого полісахариду, іммобілізація відбувається через незаряджені альдегідні групи, але в тих випадках, коли негативний заряд матриксу є бажаним, його можна одержати, використовуючи перйодат-окислений декстран-сульфат замість перйодат-окисленого декстрану. Додатковою перевагою обраного підходу є зменшення вартості реактивів, що використовуються, та їх більша доступність.
|
|
|
|
|
|
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 313; Нарушение авторских прав?; Мы поможем в написании вашей работы!