
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. 1 страница. Учебно-методическое пособие
|
|
|
|
Москва 2010
И ТЕХНОЛОГИИ КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
МАТЕРИАЛОВЕДЕНИЕ
ПРИБОРОСТРОЕНИЯ И ИНФОРМАТИКИ
Бычков Р.А.
Учебно-методическое пособие
предназначено для студентов, обучающихся по специальности
20.02.03 и 20.02.04.
Информация к размышлению. Стандарт дисциплины.
Материаловедение: строение металлов и сплавов, пластическая деформация, влияние нагрева на структуру и свойства деформированного металла, механические свойства металлов и сплавов, конструкционные материалы, термическая и химико-термическая обработка металлов, конструкционные пластики, композиты, электротехнические материалы; технология конструкционных материалов: получение заготовок литьём и пластическим деформированием, пайкой и склеиванием материалов, формообразование поверхностей деталей резанием, электрофизическими и электрохимическими способами обработки, обработка поверхностей деталей абразивным инструментом, точность обработки и шероховатость поверхностей деталей, типовое технологическое оборудование и инструменты.
Оглавление
1. Введение. 3
2. Структура твёрдых тел. 4
2.1. Механизм кристаллизации 12
2.2. Термодинамика кристаллизации 13
2.3. Правило фаз Гиббса, фазовые диаграммы 14
2.4. Процессы структурообразования 18
2.5. Надмолекулярная структура полимеров 23
3. Основные свойства материалов 26
3.1. Механические свойства материалов 26
3.2. Теплофизические свойства материалов 30
3.3. Электрические свойства материалов 34
3.3.1. Проводники, полупроводники, диэлектрики 34
3.3.2. Основные электрические характеристики материалов 36
3.4. Магнитные свойства материалов 46
4. Металлические материалы. 50
5. Стёкла, ситаллы. 74
6. Техническая керамика 76
|
|
|
7. Полимерные материалы 95
8. Углеродные материалы и композты 141
9. Полупроводниковые материалы
9. Технология конструкционных материалов 148
9.1. Технология металлических материалов 148
9.2. Переработка полимерных материалов 157
9.3 Технология стеклянных материалов 169
9.4. Технология керамических материалов 174
Проверить нумерацию рисунков, таблиц.
Материаловедение – наука о материалах, методах их получения, переработке, об их свойствах и областях их использования. Правильный выбор материалов даёт важный, иногда определяющий эффект в создании высокоэффективных и экономичных приборов, машин и механизмов.
Материалы могут находиться в различных фазовых и агрегатных состояниях. По электрическим свойствам они подразделяются - на проводники, полупроводники и диэлектрики (включая электроизоляционные материалы). По магнитным свойствам - на сильномагнитные и слабомагнитные.
Свойства материалов определяются их строением и видами связей, которыми атомы и молекулы связаны между собой.
Существует 3 типа химических связей – ионная, ковалентная и металлическая. Ковалентная связь заключается в образовании общих электронных пар атомов, ионная – в переходе валентных электронов от одного атома к другому и образованию разноимённо-заряженных ионов. Металлическую связь можно рассматривать как разновидность ковалентной связи с тем отличием, что общая пара электронов делокализована, т.е. не имеет постоянного места. Этим объясняется электропроводность, теплопроводность, ковкость, пластичность металлов.
Эти 3 типа химических связей являются идеализированными представлениями о химическом связывании. В действительности реализуется некоторое промежуточное состояние и когда говорят, например, что какое-либо вещество является ковалентным, то подразумевают, что в химической связи вклад ковалентности преобладает.
|
|
|
Прочность ковалентных химических связей достаточно велика. Так, прочность связи в молекуле водорода составляет 436 кДж/моль, связь Н – СН3 435 кДж/моль, связь СН3-СН3 - 368 кДж/моль, связь СН3-С6Н5 – 389 кДж/моль, связь Si-О – 432 кДж/моль.
Ковалентные связи могут быть полярными и неполярными. Связь будет полярной, если она образуется между атомами с различной электроотрицательностью. В этом случае электронные облака смещаются к более электроотрицательному атому. В результате на более электроотрицательном атоме образуется условный отрицательный заряд δ-, а на менее электроотрицательном атоме – условный положительный заряд δ+. Если в молекуле имеются полярные ковалентные связи и молекула не симметрична, то она будет полярной. Мерой её полярности является электрический момент диполя m. Момент диполя m есть вектор, направленный от положительного заряда к отрицательному и равный произведению заряда q и расстояния L между зарядами m = q L. Размерность – Дебай D. 1D = 3,33·10-30 Кл·м. Наиболее полярные связи – ионные. Например, в КВr дипольный момент равен 10 D. Ковалентные связи менее полярны, m = 0,5 ¸ 4 D.
Важную роль играют более слабые (4 – 40 кДж/моль) межмолекулярные связи. Они включают силы Ван-дер-Ваальса и водородную связь. Силы Ван-дер-Ваальса – это ориентационные, индукционные и дисперсионные взаимодействия. Особенно прочны межмолекулярные водородные связи, например, в воде между атомом Н одной молекулы и атомом О другой молекулы, между Н и N в аммиаке. Эти связи существенны в жидкостях, в аморфных веществах, в биологических структурах. Для иллюстрации влияния водородных связей на свойства веществ можно привести температуры плавления и кипения халькогенидов водорода.
| Халькогенид | Тпл оС | Ткип оС |
| Н2О | 0 (экстраполяция = -120оС) | +100 (экстраполяция =-90оС) |
| Н2S | -85,6 | -60,7 |
| Н2Se | -64 | -42 |
| Н2Те | -48 | -1,8 |
Если бы в воде не было водородных связей, то можно было бы ожидать плавление воды при – 120оС и кипение при -100оС, т.е. в наших условиях вода была бы в газообразном состоянии.
Межмолекулярные связи обусловливают склеивание и прилипание, влияют на многие характеристики материалов, на прочностные свойства.
2. Структура твёрдых тел.
Одно и то же твёрдое вещество в зависимости от условий затвердевания может быть в кристаллическом или в аморфном состоянии. Для твёрдого вещества обычным является кристаллическое состояние – это состояние почти полной упорядоченности материальных частиц – атомов, ионов или молекул, из которых состоит вещество. Упорядоченность расположения этих частиц в значительных объёмах вещества обозначают термином «дальний порядок». В аморфных веществах дальнего порядка нет, – там существует «ближний порядок». Под этим термином подразумевается, что с определённой долей вероятности можно судить только о среднем количестве частиц в ближайшем окружении интересующей нас частицы. В газообразном состоянии вещество полностью неупорядоченно.
|
|
|
Вещество в кристаллическом состоянии может находиться в виде собственно кристаллов, например, NaС1, алмаз, или в виде поликристаллических агрегатов (мрамор, большинство металлов). Кристаллическое состояние, в отличие от аморфного, характеризуется определённой температурой плавления Тпл, часто – геометрической формой, во многих случаях – анизотропией свойств.


 Обычно из более простых и симметричных частиц получаются более простые и симметричные кристаллические постройки. Так, шарообразные частицы, например, атомы или одноатомные ионы, образуют кристаллические структуры, которые почти буквально повторяют наиболее плотные упаковки подшипниковых шариков или мячей настольного тенниса
Обычно из более простых и симметричных частиц получаются более простые и симметричные кристаллические постройки. Так, шарообразные частицы, например, атомы или одноатомные ионы, образуют кристаллические структуры, которые почти буквально повторяют наиболее плотные упаковки подшипниковых шариков или мячей настольного тенниса
– по гексагональному закону.







Рис.2.1. Плотнейшая упаковка шаров в одном слое.
В зависимости от того, как будут укладываться такие последующие слои шаров относительно предыдущих, могут образовываться как «гексагональная плотнейшая упаковка», так и «кубическая плотнейшая упаковка».
Чтобы установить тип упаковки, нужно определить тип симметрии данного атомного расположения и выделить соответствующую структурную единицу. Сначала остановимся на структурной единице. Всякий повторяющийся узор можно разделить на множество «мотивных единиц», совершенно одинаковых, соприкасающихся друг с другом без промежутков (смотри рис. 2.2). Следовательно, в принципе выбор мотивной единицы произволен. Обычно наиболее удобно считать единицей узора – структурной единицей параллелограмм с кратчайшими сторонами и с углами, наиболее близкими к прямым.
|
|
|
По тем же принципам анализируются пространственные узоры, которые всегда можно разделить на единицы в форме ящиков, называемых «элементарными ячейками» (смотри рис. 2.3).

Рис.2.2. Плоский узор. Рис.2.3. Пространственный узор, элементарная ячейка.
Элементарная ячейка полностью определена тогда, когда известны:
1) все три ребра повторяющегося параллелепипеда;
2) углы, которые образуют между собой три ребра ячейки;
3) тип, число и положение структурных единиц (атомов, ионов, молекул), из которых состоит ячейка.
Число частиц, окружающих данную частицу, называется «координационным числом» (к.ч.). К.ч. £ 12.
Всего известно 14 видов пространственных решёток, которые различаются между собой по симметрии и формам элементарных ячеек. Эти 14 видов решёток геометрически вывел французский кристаллограф О.Браве. 14 решёток Браве подразделяются на 4 типа: 1) примитивные – имеют узлы (т.е. материальные частицы – атомы, ионы, молекулы) в вершинах ячейки.
2) базоцентрированные – узлы находятся в вершинах и в центрах двух противоположных гранях;
3) объёмноцентрированные – узлы находятся в вершинах и в центре ячейки;
4) гранецентрированные – узлы находятся в вершинах и в центре каждой грани.
В примитивных решётках на одну элементарную ячейку приходится всего одна частица. Может показаться, что примитивная элементарная ячейка содержит 8 частиц, которые находятся в узлах ячейки. В действительности каждая частица, находящаяся в узле ячейки, принадлежит восьми ячейкам, а данной ячейке принадлежит 1/8 этой частицы.
В базоцентрированных решётках на одну ячейку приходится 2 частицы: 8 восьмушек (8 х 1/8) и две половинки. Столько же частиц приходится на одну ячейку в объёмноцентрированных решётках.
Больше всего частиц в одной ячейке приходится в гранецентрированных решётках – четыре. 8 х 1/8 и 6 половинок в каждой из шести граней.
Плотность упаковки ячеек возрастает от 1-го к 4-му типу. Плотность упаковки – это отношение объёма, занятого атомами, к общему объёму элементарной ячейки. Когда в кристаллической решётке (элементарной ячейке) в узлах помещают шарики, надо иметь в виду, что они изображают не частицы (атомы), а центры тяжести этих атомов. Атомы же упруго соприкасаются друг с другом, как показано на рис. 2.4.
Рис.2.4. Объёмное изображение структуры гексагональной плотной упаковки.
Русский учёный Е.С.Фёдоров показал, что 14 элементарных решёток в кристаллических многогранниках могут совмещаться (взаимное проникновение), образуя 230 возможных комбинаций или пространственных групп.
Способ упаковки материальных частиц или, иначе, вид элементарной ячейки, определяет форму кристаллов. Кристаллы ограничиваются плоскими гранями, пересекающимися на рёбрах, которые, в свою очередь, пересекаются в вершинах. Форма кристаллов весьма разнообразна, но симметрична. В кристаллах различают следующие элементы симметрии:
1) плоскость симметрии – воображаемая плоскость, делящая кристалл на 2 части, являющимися зеркальными отражениями друг друга;
2) ось симметрии – линия, при вращении вокруг которой кристалл некоторое число раз совмещается сам с собой. Это число определяет порядок оси. Доказано, что в кристаллах возможны оси симметрии только 2, 3, 4 и 6 порядков;
3) центр симметрии – точка внутри кристалла, в которой пересекаются и делятся пополам линии, соединяющие соответственные точки на поверхности кристалла.
В кристаллах элементы симметрии могут встречаться как поодиночке, так и в сочетании друг с другом. Полная совокупность элементов симметрии многогранника называется видом симметрии. Русский академик А.В.Гадолин в 1867 г. доказал, что возможны 32 вида симметрии, которые сгруппированы в 7 кристаллографических систем или сингоний.
Таблица 1.
КРИСТАЛЛОГРАФИЧЕСКИЕ СИНГОНИИ
| КАТЕГОРИЯ | СИНГОНИЯ | Углы между осями | Длина осей |
| Низшая | триклинная моноклинная ромбическая | a ¹ b ¹g ¹ 900 a = b = 900 ¹ g a = b = g = 900 | x ¹ y ¹ z x ¹ y ¹ z x ¹ y ¹ z |
| Средняя | Тригональная Тетрагональная Гексагональная | a = b = g ¹ 900 a = b = g = 900 ось z перпендикулярна к осям х, у, u, которые расположены под углом 600 или 1200 | x = y = z x = y ¹ z |
| Высшая | Кубическая | a = b = g = 900 | x = y = z |
Практически все металлы (78%) кристаллизуются в трёх типах решёток: объёмноцентрированной кубической (ОЦК), гранецентрированной кубической (ГЦК) и гексагональной плотноупакованной (ГП). В зависимости от размеров атомов и типа решётки длина осей решётки металлов сотавляют от 2 до 6 Å. (Å – ангстрем, = 10-10 м).
У различных веществ, принадлежащих к одной сингонии, углы между гранями иногда могут несколько отличаться, но у всех кристаллов данного вещества одной кристаллической формы углы между гранями постоянны. Это установили Стено в 1669 г. и Роме де Лиль в 1772 году.
В природе встречаются вещества, кристаллизующиеся одинаковым образом в одной кристаллической системе. Такие вещества называют изоморфными. Точные измерения показали, что кристаллы изоморфных веществ не всегда строго одинаковы по форме, а только относительно близки. Так
ZnCO3 MgCO3 FeCO3 MnCO3 CdCO3 CaCO3 кристаллизуются в тригональной сингонии в форме ромбоэдров, однако характерные углы ромбоэдра a для них несколько различны:
103028’ 103021’ 103004’ 102050’ 102030’ 101055’.
Обнаружилось, что изоморфные вещества в ряде случаев способны кристаллизоваться совместно с образованием смешанных кристаллов переменного состава.
Не все вещества с одинаковой кристаллографической формой и химически сходные между собой способны образовывать смешанные кристаллы. Для совместной кристаллизации необходимо, чтобы радиусы соответствующих атомов или ионов, т.е. тех частиц, которые замещают друг друга в кристаллической решётке, не отличались друг от друга более чем на 15%. Если в узлах кристаллической решётки находятся молекулы, имеющие сложную форму, то требование подобия размеров становятся более жёсткими. А для полимерных кристаллов различия в поперечниках макромолекул должны быть менее 1%, поэтому образование смешанных полимерных кристаллов – очень редкое явление.

 Смешанные кристаллы чаще называют «изоморфно-замещённымикристаллами» или «твёрдыми растворами замещения» или «фазами переменного состава». Последний термин более общий, он включает в себя и другие структуры, например, твёрдые растворы внедрения, дефицитные структуры. Термин «твёрдые растворы» подчёркивает аналогию с распределением одного компонента в другом, наблюдаемую в обычных растворах, а именно, - в среднем равномерное, но случайное распределение компонентов. Для жидких растворов состояние их описывается «фазовой диаграммой». Если компоненты смешиваются друг с другом неограниченно, то диаграмма состояния имеет вид, представленный на рис. 2.5.
Смешанные кристаллы чаще называют «изоморфно-замещённымикристаллами» или «твёрдыми растворами замещения» или «фазами переменного состава». Последний термин более общий, он включает в себя и другие структуры, например, твёрдые растворы внедрения, дефицитные структуры. Термин «твёрдые растворы» подчёркивает аналогию с распределением одного компонента в другом, наблюдаемую в обычных растворах, а именно, - в среднем равномерное, но случайное распределение компонентов. Для жидких растворов состояние их описывается «фазовой диаграммой». Если компоненты смешиваются друг с другом неограниченно, то диаграмма состояния имеет вид, представленный на рис. 2.5.
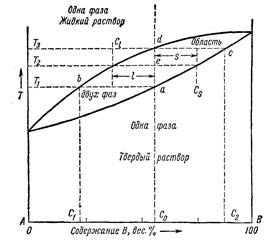
Рис. 2.5. Фазовая диаграмма двухкомпонентной системы при взаимной растворимости во всей области составов.
Верхняя линия называется линией ликвидуса, выше её система представляет собой жидкость (жидкий раствор). Нижняя линия называется линией солидуса, ниже этой линии система находится в твёрдом (кристаллическом) состоянии, в состоянии твёрдого раствора. Между линиями ликвидуса и солидуса система содержит одновременно жидкую и твёрдую фазы. Возьмём образец из сплава состава С0. При температуре ниже Т1 этот спав представляет собой гомогенный твёрдый раствор. Если температура возрастает до Т2, часть образца расплавится. Первая порция жидкости будет иметь состав С l. Эта порция богаче компонентом А, чем исходный сплав. Твёрдая (кристаллическая) часть будет иметь состав С s. Чем выше поднимается температура сплава, тем больше образуется жидкости. При каждой температуре состав жидкости характеризуется точкой на линии bd, линии ликвидуса. При любой температуре вся масса жидкости однородна по своему составу. Жидкость всегда богаче элементом А, чем исходный твёрдый сплав, а твёрдая фаза содержит меньше компонента А, чем исходный твёрдый сплав. В твёрдых растворах параметры кристаллических решёток изменяются пропорционально составу. Знание фазовой диаграммы для данной смеси веществ позволяет изготовить твёрдый раствор любого заданного состава.
Другой разновидностью твёрдых растворов являются «твёрдые растворы внедрения». В этом случае в кристаллическую решётку (чаще всего металлическую) в междоузлия внедряются атомы неметалла. Очевидно, что это возможно тогда, когда в кристаллической решётке матричного вещества имеются «пустоты», а внедрённые атомы малы и их размеры соизмеримы с этой «пустотой». Понятно, что возможны только ограниченные твёрдые растворы. К атомам, которые могут располагаться в междоузлиях металлической решётки, относятся Н, С, N, O, B, Si. Присутствие внедрённых атомов вызывает напряжение в материнской решётке, искажение кристаллической решётки вплоть до изменения её симметрии, например, переход кубической симметрии в тетрагональную.
Кроме явления изоморфизма в кристаллических веществах проявляется полиморфизм. Явление полиморфизма состоит в том, что в зависимости от условий (температуры, давления) одно и то же вещество может образовывать разные по симметрии и форме кристаллы. Эти формы, называемые полиморфными разновидностями или модификациями, принято обозначать буквами a, b, g и т.д., причём a обычно относится к модификации, стабильной при наиболее низкой температуре.
Структуру кристаллов изучают рентгеновскими методами. Впервые для изучения кристаллов рентгеновские лучи (X-ray) использовал молодой доцент в Мюнхене М. Лауэ в 1912 году. Через год В.Г.Брэгг (впоследствии сэр Вильям) в Лидсе и его сын В.Л.Брэгг (впоследствии сэр Лоренс) в Кембридже видоизменили метод Лауэ – использовали рентгеновские лучи со строго определённой длиной волны l, при этом наблюдали дифракцию рентгеновских лучей. В.Л. Брэгг вывел уравнение, устанавливающее зависимость между углом дифракции θ, длиной волны рентгеновских лучей l и расстоянием между последовательными атомными слоями d, которое с тех пор успешно применяется для определения параметров кристаллических решёток. Простота уравнения действительно исключительна: nl = 2d Sinθ, где n равно 1, 2, 3 или любому целому числу. Когда различие в пройденном пути луча 2 и луча 1 nA' + A'm равно nl - происходит интерференция и на фотографической пластинке появляется пятно. Зная l, можно определить d – межплоскостное расстояние и, следовательно, параметры кристаллической решётки.

Рис.2.6. Схема отражения лучей от одномерной структуры с периодом d (So — падающие лучи, S — дифрагированные; разность хода между лучами, отраженными от двух плоскостей, равная пА' + тА' = 2d sinθ; угол между падающим и дифрагированным лучом равен 2θ).
В зависимости от природы частиц, образующих кристалл, различают 4 основных типа кристаллических структур: атомные, молекулярные, ионные и металлические.
В кристаллах с атомной структурой в узлах решётки находятся атомы, между которыми действуют ковалентные связи. Такие кристаллы обладают высокой температурой плавления Тпл, большой твёрдостью. Примером могут служить алмаз, карбид кремния.
В кристаллах с молекулярной структурой в узлах решётки находятся полярные или неполярные молекулы, между которыми действуют межмолекулярные силы. Такие структуры имеют низкие Тпл, невысокую твёрдость. Примером могут служить кристаллы СО2 (сухой лёд), парафин, полиэтилен.
Кристаллы с ионной структурой имеют высокие Тпл и Ткип. Примеры – NaCl, CaCO3.
Особое место занимает металлическая структура. Металлическая связь по своей природе близка к ковалентной, но, в отличие от обычной ковалентной, образуется делокализованными, т.е. не имеющими постоянного места, электронами, не имеет направления, поэтому металлы обладают металлическим блеском, электропроводностью, теплопроводностью и ковкостью.
Реальные кристаллы отличаются от идеальных тем, что они несовершенны, они имеют дефекты – частичное нарушение порядка расположения материальных частиц. Простейшим видом дефектов являются тепловые колебания составных частей решётки. Средняя амплитуда атомных колебаний µ Ö`Т. Легко подсчитать, что при нагревании от комнатной температуры (300 К) до Тпл многих элементарных кристаллов (1200 – 1900 К) амплитуда колебаний увеличивается в 2 – 2,5 раза. При 300 К амплитуда @ 0,2 Ао, следовательно, при Тпл амплитуда составляет @ 0,5 Ао. Как видим, тепловые колебания атомов даже в состоянии «предплавления» на порядок меньше межатомных расстояний = nАо. Таким образом, переход кристалла к расплаву не означает полного уничтожения порядка.
Истинная энергия каждого атома не равна средней энергии. В кристалле существуют атомы, энергия которых настолько велика, что они способны покинуть регулярные позиции в узлах решётки и перейти в промежуточное положение, называемое междоузлиями. Образовавшийся в результате этого незанятый узел называется вакансией, а атом, попавший в междоузлие – внедрённым атомом. Вакансии и внедрённые атомы – это простейшие виды точечных дефектов в кристаллах, они носят название «дефекты по Френкелю».
Вакансий в кристаллах очень мало – даже при Тпл их одна на 1000 регулярно расположенных атомов.
Существует другой механизм образования вакансий, энергетически более выгодный. Суть его заключается в том, что тепловые колебания атомов поверхности кристалла выбрасывают атом на поверхность. Образовавшееся пустое место занимается атомом из более глубокого слоя, на месте которого и образуется вакансия. Образовавшаяся вакансия за счёт обмена местами с атомами узлов перемещается в глубь кристалла. Вакансии, образовавшиеся по этому механизму, называются «дефектами по Шотки».
Помимо того, что точечные дефекты влияют на свойства материалов – теплопроводность, электрические и диэлектрические свойства, магнитные, оптические, механические и др., эти дефекты нужны кристаллу для его устойчивости. Различного рода дефекты - это тот беспорядок, который порядку необходим, он в некоторой степени компенсирует уменьшение DS при кристаллизации.
Другие виды дефектов – это трещины, поры и дислокации. Дислокация – это линейный (а не точечный) дефект кристаллической решётки, нарушающий правильное чередование атомных плоскостей и образующих внутри кристалла границу зоны сдвига. В простых решётках существует два вида дислокаций – краевая и винтовая дислокации.
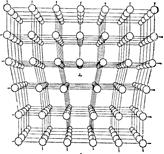
Рис.2.7. Расположение атомов, соответствующее краевой дислокации.
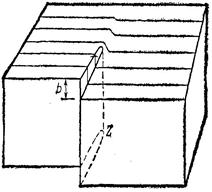
Рис.2.8. Структура кристалла с винтовой дислокацией.
В кристаллах встречаются и так называемые смешанные дислокации. Дислокации не могут обрываться внутри кристалла – они должны быть либо замкнутыми, либо выходить на поверхность кристалла. Плотность дислокаций, т.е. число дислокаций, пересекающих внутри кристалла металла площадку в 1 см2, составляет 103 – 104 в наиболе совершенных монокристаллах, а в сильно деформированном металле доходит до 1012.
Таким образом, все дефекты можно разделить на биографические (фазы переменного состава, дислокации, возникшие на стадии роста кристаллов или при их деформации) и температурные (дефекты по Шотки и Френкелю).
Во многом образование дислокаций связано с механизмом кристаллизации.
2.1. Механизм кристаллизации.
Кристаллы образуются при охлаждении расплавов или насыщенных растворов и при испарении растворителя из растворов. Иногда кристаллы образуются непосредственно при охлаждении паров, минуя жидкую фазу (снег) или на холодных поверхностях (иней). Первой стадией процесса кристаллизации является образование мельчайших кристалликов – «зародышей кристаллизации». Это происходит при некотором переохлаждении расплава ниже Тпл или раствора ниже температуры насыщения.
Когда кристаллические зародыши уже появились, они начинают расти, непрерывно увеличиваясь в размерах. Частицам легче закрепиться на готовом кристалле, чем создавать новые зародыши.
Таким образом, кинетика кристаллизации складывается из двух величин – скорости образования зародышей и скорости роста кристаллов. Общим условием, необходимым для выделения кристаллов из раствора, расплава или пара является пересыщение или переохлаждение. Только полимерные кристаллы могут выращиваться из разбавленных растворов. Скорость образования кристаллического материала пропорциональна скорости образования зародышей, а также скорости их последующего роста.
Образованию зародышей кристаллизации препятствует тепловое движение, которое может разбросать, разрушить случайно, по флуктуационному механизму сошедшиеся вместе частицы (атомы, ионы, молекулы). Необходимо, чтобы образующийся зародыш имел размеры, способные противостоять разрушающему действию тепла. Устойчивый зародыш или зародыш критического размера представляет собой кристалл, который по своим размерам находится в равновесии со средой, поэтому вероятность его роста и растворения (расплавления) одинакова.
Скорость образования зародышей максимальна при температурах значительно ниже Тпл. Линейная скорость роста кристаллов, напротив, имеет максимум немного ниже Тпл. Обычно Ткр = 8/9 Тпл. (рис.2.9).
При высокой температуре, близкой к Тпл, устойчивые зародыши имеют большие размеры, но их очень мало. В результате при изотермической кристаллизации вырастают крупные кристаллы. При низкой температуре появляется много мелких зародышей, – в результате образуется мелкокристаллическая структура.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 611; Нарушение авторских прав?; Мы поможем в написании вашей работы!