
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники
Химический источник тока — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идёт от анода к катоду, то есть от отрицательного электрода к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и др.;
- в качестве окислителя (материал катода) — оксид свинца PbO2, гидроксооксид никеля NiOOH, оксид марганца MnO2 и др.;
- в качестве электролита — растворы щелочей, кислот или солей.
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы, которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются, что позволяет ему функционировать непрерывно.
Деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Аккумулятором называется прибор, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию в результате химических процессов.
В аккумуляторе, как и в гальваническом элементе, электрический ток является следствием химических процессов. Но в отличие от аккумулятора в гальваническом элементе получающиеся химические соединения не могут быть вторично разложены и приведены в первоначальное состояние током постороннего источника. Поэтому гальванические элементы называются первичными, а аккумуляторы — вторичными или обратимыми. Повторные заряд и разряд не только не вредят аккумулятору, но даже улучшают его свойства, так как в работе участвуют все более глубокие слои пластин электродов.
В зависимости от состава электролита аккумуляторы могут быть кислотными и щелочными. Простейший кислотный аккумулятор состоит из двух свинцовых пластин (электродов), погруженных в электролит, которым служит вода с небольшим добавлением серной кислоты.
Постоянный ток постороннего источника, проходя через электролит, разлагает его на составные части. Внутри электролита возникает движение положительных ионов водорода Н2 к пластине, соединённой с отрицательным зажимом источника тока, и отрицательных ионов кислорода О к пластине, соединённой с положительным зажимом источника тока. В результате 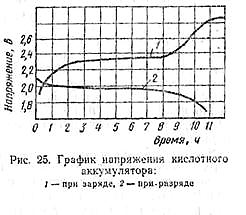 электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном электроде. Таким образом электрическая энергия преобразовывается в химическую и аккумулятор становится заряженным.
электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном электроде. Таким образом электрическая энергия преобразовывается в химическую и аккумулятор становится заряженным.
Химическая энергия может сохраняться определенное время и при надобности легко переходит в электрическую.
Если аккумулятор отключить от источника тока и замкнуть на какой-нибудь приемник энергии, то аккумулятор сам станет источником тока подобно гальваническому элементу, у которого электродами служат пластины, отличающиеся друг от друга по химическому составу.
Электролитом в кислотных аккумуляторах, как указывалось выше, служит раствор серной кислоты определенной плотности. Плотностью раствора или его удельным весом называется число, показывающее, во сколько раз вес этого раствора больше веса воды того же объёма.
Для наполнения стационарных аккумуляторов употребляют раствор серной кислоты плотностью 1,21 при 15° С. Для переносных аккумуляторов применяют раствор серной кислоты плотностью 1,26.
Плотность электролита определяют ареометром. Он представляет собой стеклянную трубку, запаянную с обеих концов и имеющую внутри шкалу с делениями. В нижней расширенной части ареометра находится ртуть или дробь, в результате чего трубка плавает вертикально. Ареометр опускают в сосуд с электролитом. Чем больше плотность электролита, тем выше поднимается ареометр из жидкости. Деление ареометра, расположенное на уровне раствора, показывает плотность электролита.
При составлении раствора для аккумуляторов серную кислоту тонкой струей наливают в воду. Нельзя вливать в серную кислоту воду, так как произойдёт бурное разбрызгивание кислоты, которая может причинить ожоги. Вода для электролита должна быть дистиллированной.
Внутреннее сопротивление аккумуляторов очень мало по сравнению с внутренним сопротивлением гальванических элементов. Это даёт возможность считать напряжение на зажимах аккумуляторной батареи примерно равным её э. д. с. Однако внутреннее сопротивление не является постоянной величиной. Оно определяется составом пластин, расстоянием между ними, плотностью и температурой электролита, степенью заряженности аккумулятора. Так, сопротивление разряженного аккумулятора примерно в полтора- два раза больше, чем заряженного.
Э. д. с. аккумулятора зависит от плотности электролита и не зависит от его размеров и номинальной ёмкости. При плотностях электролита d в пределах 1,1—1,35 э. д. с. аккумулятора
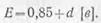
|
|
Дата добавления: 2015-05-06; Просмотров: 610; Нарушение авторских прав?; Мы поможем в написании вашей работы!