
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 17. 1Основные виды хим. связи
|
|
|
|
1Основные виды хим. связи. Количественные характеристики хим. связи: длина связи м\у атомами, энергия связи, валентные углы. Электронная теория валентности Льюиса-Косселя. Ионный и ковалентный характер связи.
Химическая связь – состояние взаимодействующих атомов, характеризующееся минимумом энергии. Ковалентная – связь осуществляемая за счет образования электронной пары, принадлежащей обоим атомам(Н2, С12). Ионная – связь осуществляемая за счет электростатического притяжения между ионами(NaCl). Водородная – это связь между полож. заряженным атомом водорода и отрицательно заряженным атомом другой молекулы. Металлическая – связь когда валентные электроны металлов слабо связаны со своими ядрами и могут легко отрываться от них. Энергией связи называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль. Например, энергия связи Н—Н в молекуле водорода равна 436 кДж/моль. Если в молекуле несколько одинаковых связей, то, очевидно, для разрушения каждой следующей потребуется различная энергия и в таком случае говорят о средней энергии связи. Величина энергии химических связей в большинстве соединений колеблется в пределах 100-1000кДж/моль. Энергия связи в ряду однотипных молекул постепенно изменяется. Например, энергия связи Н-Г в ряду гало-геноводородов HF, HC1, HBr, HI уменьшается с 565,7 кДж/моль у HF, до 294,7 кДж/моль у HI. Зная энергию связей в молекуле, можно судить также о ее реакционной способности и производить различные термохимические расчеты. Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
|
|
|
В ряду аналогичных по составу молекул длины связей также изменяются закономерно. Например, в ряду HF, НС1, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна 0,091; 0,127; 0,141; 0,160нм. В молекулах, близких по химической природе, одного гомологического ряда, длины связей между ядрами элементов мало различаются и могут считаться практически постоянными (например, длины связей С - С в предельных углеводородах и т. д.).
Кроме того, на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, межъядерные расстояния уменьшаются. Так, длина связи С—С равна 0,154 нм, С = С - 0,135 нм и С ≡ С - 0,121 нм.
Валентные углы- это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°. Электронная теория валентности Льюиса-Косселя В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней .2.Изолированные неизолированные сис-мы. Функции состояния, уравнения состояния. Работа, теплота, энергия. Температура. Внутренняя энергия. Термодинамические системы могут быть открытыми и закрытыми. Открытые системы обмениваются с окружающей средой и веществом, и энергией. Закрытые системы делятся на неизолированные и изолированные. Неизолированные системы не обмениваются с окружающей средой веществом, но обмениваются энергией. Изолированные системы не обмениваются ни веществом, ни энергией. Энтальпия(H) - термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц,энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.. Энтропия (S) – термодинамическая функция состояния, которая является мерой беспорядка, хаотичности, неупорядоченности в системе. Энтропия имеет размерность энергии, деленной на температуру. Выражают в [ДЖ/моль*кельвин]. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
|
|
|
Энергия Гиббса(G)- называемая также изобарно-термическим потенциалом или свободной порцией при постоянном давлении. G связана с H,S,T: G=H-TS. Если реакция осуществляется при постоянных P и Т, то ∆G=∆H-T∆S. При постоянстве температуры и давления хим.реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается. При низких температурах самопроизвольно могут протекать экзотермические реакции, а при высоких – реакции сопровождающиеся влечение энтропии. Внутренняя энергия(U) – энергия межмолекулярных внутримолекулярных взаимодействий. Она складывается из кинетической и потенциальной энергий частиц. Кинетическая- энергия поступательного, колебательного и вращательного движения частиц. Потенциальная - обусловлена силами притяжения и отталкивания, дейст. между частицами. U зависит от состояния в-ва. Энергия – мера способности совершать работу или передавать тепло. Температура - - свойство, определяющее направление перехода теплоты от одного объекта к другому. Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
|
|
|
Передача теплоты – передача энергии, вызываемая разностью температур между системой и ее окружением или между одной системой и другой системой. Работа - форма передачи энергии от одной системы к другой или от системы к ее окружению.
Функции состояния связаны между собой математическими соотношениями – уравнениями состояния.
Уравнение состояния идеального газа:
PV=nRT
Уравнение Ван дер Ваальса:
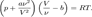 3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
Сольволиз — реакция обменного разложения между растворенным веществом и растворителем. Гидролиз солей - это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды. Это обратимая реакция нейтрилизации.
- Если соли образованы катионом сильного основания и анионом сильной кислотой 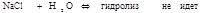 ;- Если соли образованы катионом сильного основания и анионом слабой кислотой
;- Если соли образованы катионом сильного основания и анионом слабой кислотой 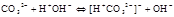 гидролиз идёт по слабому аниону, который забирает себе ион водорода. Среда щелочная, так как концентрация ионов гидроксила превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
гидролиз идёт по слабому аниону, который забирает себе ион водорода. Среда щелочная, так как концентрация ионов гидроксила превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
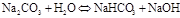 - Если соли образованы катионом слабого основания и анионом сильной кислотой
- Если соли образованы катионом слабого основания и анионом сильной кислотой
|
|
|
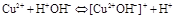
гидролиз идёт по слабому катиону, который забирает себе ион гидроксила. Среда кислая, так как концентрация ионов водорода превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
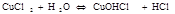
- Если соли образованы катионами слабого основания и анионами слабой кислоты 
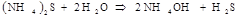 гидролиз идёт ДО КОНЦА, реакция НЕОБРАТИМА
гидролиз идёт ДО КОНЦА, реакция НЕОБРАТИМА
Степень гидролиза - это отношение числа молекул, подвергшихся гидролизу 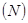 к общему числу молекул в растворе
к общему числу молекул в растворе 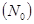 :
:
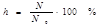
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесие процесса гидролиза.
- Если соль образована кислотой то 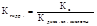
- Если соль образована слабым основанием то 
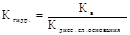
- Если соль образована слабой кислотой и слабым основанием то 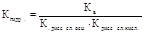
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!