
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Универсальная газовая постоянная. Средняя квадратичная скорость молекул. Постоянная Больцмана и средняя кинетическая энергия одной молекулы
Параметры, определяющие состояние вещества. Идеальный газ. Вывод основного уравнения кинетической теории газов. Вывод основных газовых законов. Уравнение состояния идеальных газов.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры. Состояние заданной массы m идеального газа определяется значениями трёх параметров: давления P, объёма V, и температуры Т.
Уравнение состояния идеального газа или уравнение Менделеева - Клапейрона является обобщением законов идеального газа, открытых экспериментально до создания МКТ. Однако, из основного уравнения МКТ (2.3), можно получить уравнение состояния идеального газа. Для этого подставим вместо средней кинетической энергии поступательного движения молекулы в основное уравнение МКТ идеальных газов правую часть равенства (2.4), получим уравнение, в которое не входят микропараметры газа  (2.5). Так как
(2.5). Так как  , следовательно,
, следовательно,  или
или  . Учитывая, что
. Учитывая, что 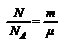 , получим N=NA
, получим N=NA 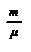 , а так как NA × k = R = 8,3
, а так как NA × k = R = 8,3 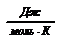 - молярная газовая постоянная [2,3,5,15] или универсальная газовая постоянная [1,6,7,], то получим уравнение Менделеева
- молярная газовая постоянная [2,3,5,15] или универсальная газовая постоянная [1,6,7,], то получим уравнение Менделеева  (2.6). Уравнение состояния газа часто удобно использовать в записи, предложенной Клапейроном, если количество вещества не изменяется
(2.6). Уравнение состояния газа часто удобно использовать в записи, предложенной Клапейроном, если количество вещества не изменяется 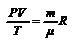 или
или  (2.7). Уравнение (2.7) часто называют обобщённым газовым законом. Тот факт, что из основного уравнения молекулярно-кинетической теории идеального газа можно вывести уравнение состояния идеального газа, подтверждает верность молекулярно-кинетической теории вещества.
(2.7). Уравнение (2.7) часто называют обобщённым газовым законом. Тот факт, что из основного уравнения молекулярно-кинетической теории идеального газа можно вывести уравнение состояния идеального газа, подтверждает верность молекулярно-кинетической теории вещества.
Основное уравнение молекулярно – кинетической теории газов. Возьмем сосуд с газом и определим давление P газа на стенки сосуда. Для простоты рассмотрения выберем этот сосуд в форме куба с ребром l и расположим его в декартовой системе координат, как показано на рисунке. Пусть в сосуде имеется всего N молекул. Предположим, что:
1)Вдоль оси х движется одна треть всех молекул, т.е.  ;
;
2)Удар молекул о стенку Q идеально упругий и молекулы проходят расстояние, равное размеру куба, не испытывая соударений.
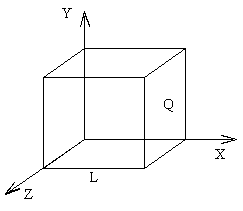 Импульс силы, полученный стенкой при ударе молекулы, определим из второго закона Ньютона.
Импульс силы, полученный стенкой при ударе молекулы, определим из второго закона Ньютона. 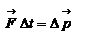 . где
. где 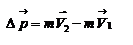 - изменение импульса молекулы, m – масса молекулы. Поскольку масса стенки намного больше массы молекулы, то
- изменение импульса молекулы, m – масса молекулы. Поскольку масса стенки намного больше массы молекулы, то  и
и 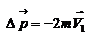 или по модулю
или по модулю 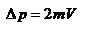 , где использовано обозначение
, где использовано обозначение 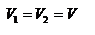 . Таким образом, одна молекула одна молекула за время D t передает стенке импульс силы
. Таким образом, одна молекула одна молекула за время D t передает стенке импульс силы 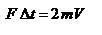 , а за время
, а за время 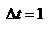 сек передаёт стенке импульс силы равный
сек передаёт стенке импульс силы равный 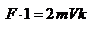 , где k – число ударов молекул за 1 сек.
, где k – число ударов молекул за 1 сек. 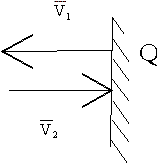 Так как
Так как 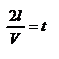 - промежуток времени между двумя последовательными ударами,. то
- промежуток времени между двумя последовательными ударами,. то 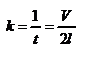 , тогда
, тогда 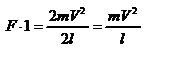 . Теперь подсчитаем суммарный импульс силы, который передают стенке N 1 молекул, движущихся вдоль оси x, за 1 сек
. Теперь подсчитаем суммарный импульс силы, который передают стенке N 1 молекул, движущихся вдоль оси x, за 1 сек 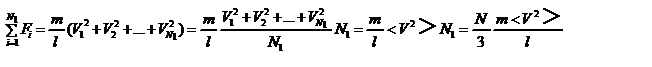 , где скобки < > обозначают среднее значение выражения, стоящего в скобках. Если извлечь корень квадратный из < V 2 >, получим среднюю квадратичную скорость молекул, которую будем обозначать < Vкв >
, где скобки < > обозначают среднее значение выражения, стоящего в скобках. Если извлечь корень квадратный из < V 2 >, получим среднюю квадратичную скорость молекул, которую будем обозначать < Vкв > 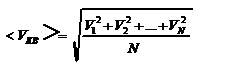 - средняя квадратичная скорость молекул газа. Давление, оказываемое газом на грань куба, равно:
- средняя квадратичная скорость молекул газа. Давление, оказываемое газом на грань куба, равно: 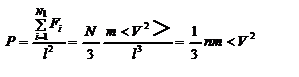 , где n – концентрация молекул. Запишем это выражение в виде
, где n – концентрация молекул. Запишем это выражение в виде  , чтобы подчеркнуть, что в левую часть этого выражения входит средняя кинетическая энергия поступательного движения молекулы
, чтобы подчеркнуть, что в левую часть этого выражения входит средняя кинетическая энергия поступательного движения молекулы 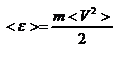 . Тогда
. Тогда 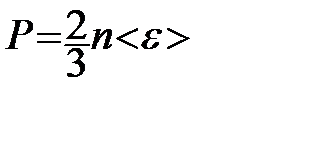 - основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) С учетом уравнения состояния идеального газа:
- основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) С учетом уравнения состояния идеального газа: 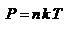 получаем выражение для средней кинетической энергии поступательного движения молекул:
получаем выражение для средней кинетической энергии поступательного движения молекул: 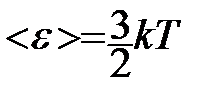 - средняя кинетическая энергия поступательного движения молекул. Мы видим, что величина kT есть мера энергии теплового движения молекул.
- средняя кинетическая энергия поступательного движения молекул. Мы видим, что величина kT есть мера энергии теплового движения молекул.
Газовые законы установлены в 17 веке экспериментально. Однако, их можно получить, используя уравнение Менделеева - Клапейрона.
Закон Бойля-Мариотта. Для данногоколичества вещества 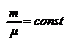 рассмотрим изотермический процесс, то есть процесс, протекающий без изменения температуры (Т= const). Используя уравнение (2.6) или (2.7), получим уравнение изотермы, выраженное через давление и объём газа:
рассмотрим изотермический процесс, то есть процесс, протекающий без изменения температуры (Т= const). Используя уравнение (2.6) или (2.7), получим уравнение изотермы, выраженное через давление и объём газа: 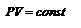 (2.7). или
(2.7). или 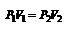 (2.7’). Для данного количества вещества при изотермическом процессе произведение давления на объём есть величина постоянная. Для построения диаграммы Р(V) выразим давление через объем
(2.7’). Для данного количества вещества при изотермическом процессе произведение давления на объём есть величина постоянная. Для построения диаграммы Р(V) выразим давление через объем  . Зависимость между давлением и объёмом – обратно пропорциональная, графически представлена гиперболой на рис.2.3 а. Температурные зависимости давления и объёма представлены на рис.2.3 б и в, соответственно.
. Зависимость между давлением и объёмом – обратно пропорциональная, графически представлена гиперболой на рис.2.3 а. Температурные зависимости давления и объёма представлены на рис.2.3 б и в, соответственно.
Закон Гей-Люссака. Для данного количества вещества  рассмотрим изобарический процесс, то есть процесс, протекающий без изменения давления
рассмотрим изобарический процесс, то есть процесс, протекающий без изменения давления
(Р = const). Используя уравнение (2.6) или (2.7), получим уравнениеизобары, выраженное через температуру и объём: 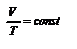 ,(2.8). через параметры начального и конечного состояния
,(2.8). через параметры начального и конечного состояния 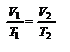 или
или 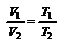 . Для данного количества вещества при изобарическом процессе отношение объёма к температуре (или наоборот) есть постоянная величина. Изобарический закон можно записать и в виде:
. Для данного количества вещества при изобарическом процессе отношение объёма к температуре (или наоборот) есть постоянная величина. Изобарический закон можно записать и в виде: 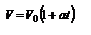 . Здесь V0 - объём газа при t=00C, t- температура в 0С, a - термический коэффициент объемного расширения;
. Здесь V0 - объём газа при t=00C, t- температура в 0С, a - термический коэффициент объемного расширения;  . Для идеального газа
. Для идеального газа 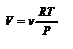 ,
,  , но
, но 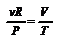 , тогда
, тогда 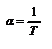 - термический коэффициент объёмного расширения идеального газа равен величине, обратной температуры. Изображение этого процесса приведено на рис. 2.4. Закон Шарля. Для данного количества вещества
- термический коэффициент объёмного расширения идеального газа равен величине, обратной температуры. Изображение этого процесса приведено на рис. 2.4. Закон Шарля. Для данного количества вещества 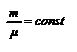 рассмотрим изохорический процесс, то есть процесс, протекающий без изменения объёма (V = const). Используя уравнение (2.6) или (2.7), получим уравнениеизохоры, выраженное через температуру и давление газа:
рассмотрим изохорический процесс, то есть процесс, протекающий без изменения объёма (V = const). Используя уравнение (2.6) или (2.7), получим уравнениеизохоры, выраженное через температуру и давление газа:  , (2.9) через параметры начального и конечного состояния
, (2.9) через параметры начального и конечного состояния  или
или  . Для данного количества вещества при изохорическом процессе отношение давления к температуре (или наоборот) есть величина постоянная.
. Для данного количества вещества при изохорическом процессе отношение давления к температуре (или наоборот) есть величина постоянная.
Изображение этого процесса приведено на рис. 2.5.
Закон Авогадро При одинаковых давлениях (Р) и температурах (Т) в равных объемах (V) любого газа содержится одинаковое число молекул. 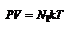
 , следовательно, N1 = N2
, следовательно, N1 = N2
Закон Дальтона (для смеси газов) Давление смеси газов равно сумме парциальных давлений Рсм=Р1+Р2+... +РК (2.10). Этот закон можно также получить, используя уравнение состояния идеального газа. 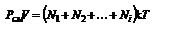 ,
, 
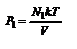 - парциальное давление - давление, которое оказывал бы данный компонент газа, если бы он один занимал весь объем, предоставленный смеси.
- парциальное давление - давление, которое оказывал бы данный компонент газа, если бы он один занимал весь объем, предоставленный смеси.
R - Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.=8,31дж/(моль*К)
Сфера.  ,
,  , число ударов о стенку за 1 с
, число ударов о стенку за 1 с 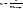 следовательно сумма всех импульсов сообщенных одной молекулой за 1 с равняется
следовательно сумма всех импульсов сообщенных одной молекулой за 1 с равняется  а у нас таких молекул
а у нас таких молекул  т.е. сумма импульсов сообщенных стенке всеми молеклами за 1 с
т.е. сумма импульсов сообщенных стенке всеми молеклами за 1 с 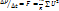 сила с которой все молекулы давят на стенку.
сила с которой все молекулы давят на стенку. 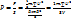 ,
, 
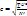 среднеквадратичная скорость одной молекул
среднеквадратичная скорость одной молекул
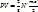 ,
,  – средняя кинетическая энергия одной молекулы.:
– средняя кинетическая энергия одной молекулы.: 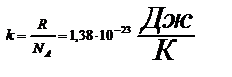 - постоянная Больцмана
- постоянная Больцмана
28. Распределение скоростей молекул по Максвеллу. Наивероятнейшая скорость.Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движени При выводе основного уравнения молекулярно-кинетической теории молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул. По молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящемся в состоянии равновесия при Т = const, остается постоянной и равной <vкв> =Ö3kT/m0. Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.При выводе закона распределения молекул по скоростям Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Предполагалось также, что силовые поля на газ не действуют.Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул намалые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN (v)/N, скорости которых лежат в интервале от v до v+dv, т. е.откуда f(v)=dN(v)/Ndv Применяя методы теории вероятностей, Максвелл нашел функцию f(v) — закон для распределения молекул идеального газа по скоростям:  Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т). График функции (44.1) приведен на рис. 65. Так как при возрастании v множитель
Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т). График функции (44.1) приведен на рис. 65. Так как при возрастании v множитель  уменьшается быстрее, чем растет множитель v2, то функция f(v), начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Кривая несимметрична относительно vв. Относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, находится как площадь более светлой полоски на рис. 65. Площадь, ограниченная кривой распределения
уменьшается быстрее, чем растет множитель v2, то функция f(v), начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Кривая несимметрична относительно vв. Относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, находится как площадь более светлой полоски на рис. 65. Площадь, ограниченная кривой распределения 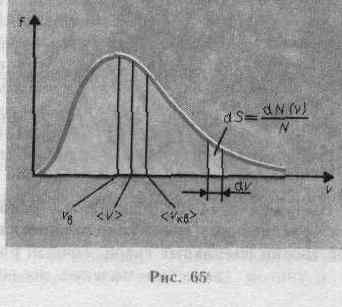 и осью абсцисс, равна единице. Это означает, что функция f(v) удовлетворяет условию нормировки
и осью абсцисс, равна единице. Это означает, что функция f(v) удовлетворяет условию нормировки  Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости ожно найти продифференцировав выражение (44.1) (постоянные множители опускаем) по аргументу v, приравняв результат нулю и используя условие для максимума выражения f(v):
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости ожно найти продифференцировав выражение (44.1) (постоянные множители опускаем) по аргументу v, приравняв результат нулю и используя условие для максимума выражения f(v): 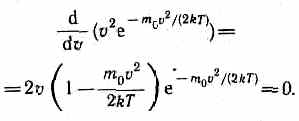 Значения v= 0и v=¥ соответствуют минимумам выражения (44.1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vв:
Значения v= 0и v=¥ соответствуют минимумам выражения (44.1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vв: 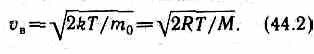 Из формулы (44.2) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 66) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться. Средняя скорость молекулы <v> (средняя арифметическая скорость)
Из формулы (44.2) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 66) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться. Средняя скорость молекулы <v> (средняя арифметическая скорость)
29. Число степеней свободы. Закон Больцмана. Внутренняя энергия газа. Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях. Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. В § 1 было введено понятие числа степеней свободы — числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три 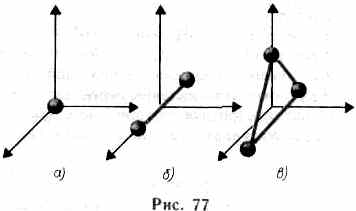 степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r—>0, J= mr2®0, T вр =Jw2/2®0). В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77,б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i=5). Трехатомная (рис. 77,0) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <e0)в (43.8):
степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r—>0, J= mr2®0, T вр =Jw2/2®0). В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77,б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i=5). Трехатомная (рис. 77,0) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <e0)в (43.8): 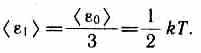 В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы 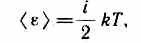 где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i =i пост+ i вращ+2 i колеб. В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул:
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i =i пост+ i вращ+2 i колеб. В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул: 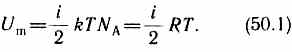 Внутренняя энергия для произвольной массы т газа
Внутренняя энергия для произвольной массы т газа 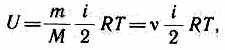 где М — молярная масса, v — количество вещества.
где М — молярная масса, v — количество вещества.
|
|
Дата добавления: 2015-04-23; Просмотров: 1878; Нарушение авторских прав?; Мы поможем в написании вашей работы!