
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Братимые и необратимые процессы. Равновесные и неравновесные процессы. Изопроцессы в газах
|
|
|
|
Равновесным состоянием системы называется такое состояние, при котором параметры системы имеют определённые значения, остающиеся при неизменных внешних условиях постоянными сколько угодно долго. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазистатическим. Из сказанного следует, что равновесным может быть только бесконечно медленный процесс. При достаточно медленном протекании реальные процессы могут приближаться к равновесному процессу сколько угодно близко. Равновесный процесс может быть проведен в обратном направлении, причём система будет проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют также обратимыми процессами. В случае обратимого процесса при возвращении в исходное состояние ни в самой системе, ни в окружающих телах не остаётся никаких изменений. Если такие изменения появляются, то такой процесс называется необратимым процессом. Все реальные процессы необратимы
1. Термодинамика изохорического процесса: V=const
Рассмотрим закон, описывающий этот процесс и его график в координатах (P,V). Этот закон является частным случаем уравнения состояния идеального газа: PV = nRT.
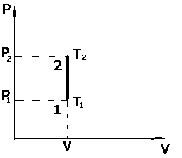
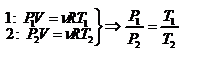 . - закон Шарля. Так как
. - закон Шарля. Так как  , то
, то 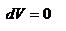 и
и 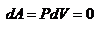 , т.е
, т.е 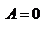 - работа совершаемая газом при изохорическом процессе равна нулю. Тогда
- работа совершаемая газом при изохорическом процессе равна нулю. Тогда 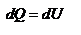 - первое начало термодинамики для изохорического процесса. Поскольку количество теплоты, сообщенное газу, равно
- первое начало термодинамики для изохорического процесса. Поскольку количество теплоты, сообщенное газу, равно 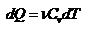 , где
, где 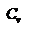 - молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа:
- молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа: 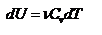 - изменение внутренней энергии газа. Сравнивая эту формулу с другой формулой
- изменение внутренней энергии газа. Сравнивая эту формулу с другой формулой 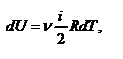 получим выражение для молярной теплоёмкости газа при постоянном объёме:
получим выражение для молярной теплоёмкости газа при постоянном объёме: 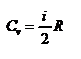 .
.
2. Термодинамика изобарического процесса: P=const.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 615; Нарушение авторских прав?; Мы поможем в написании вашей работы!