
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Это метод определения молекулярной массы вещества по температуре замерзания растворов
|
|
|
|
Это разрушение эритроцитов крови при введении гипотонического физиологического раствора.
Это отслоение цитоплазмы от стенок мембраны при обезвоживании клеток.
Плазмолиз
Гемолиз
Криоскопия
Криоскопическая постоянная К зависит от:
природы растворителя.
Эбулиоскопическая постоянная зависит от:
природы растворителя.
Осмотическое давление раствора зависит от:
концентрации растворенного вещества.
Закон Рауля применим для:
разбавленных растворов неэлектролитов.
При расчете понижения температуры замерзания и повышения температуры кипения в уравнения используется значение:
моляльной концентрации.
Формула определенеия осмотического давления для неэлектролитов:
Росм=CRT
Формула определения осмотического давления для электролитов:
Росм= i*1000*CRT
Формула определения понижения температуры замерзания для электролитов:
Dt3ам=i K Cm
Формула определения повышения температуры кипения для электролитов:
DtK=i* E * Cm
Формула определения понижения температуры замерзания для неэлектролитов:
Dt3= K * Cm
Формула определения повышения температуры кипения для неэлектролитов:
DtЗам= E * Cm
Растворы, имеющие одинаковые... это изотонические растворы.
осмотические давления
Все системы, приготовленные на основе 0,9% раствора хлорида натрия называются:
физиологическими.
Если в 100г воды растворить 9г глюкозы 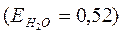 , то температура кипения раствора:
, то температура кипения раствора:
повысится на 0,26 градуса.
Если  , то температура замерзания 40%-ного раствора этилового спирта равна:
, то температура замерзания 40%-ного раствора этилового спирта равна:
-270С
Осмотическое давление крови равно Росм=725кПа, тогда 0,5М раствор глюкозы при 200С можно считать:
гипертоническим.
Если  , тогда температура кристаллизации 1Мр-ра глюкозы равна:
, тогда температура кристаллизации 1Мр-ра глюкозы равна:
|
|
|
- 1,860
Если  , то температура кипения 1М раствора сахарозы равна:
, то температура кипения 1М раствора сахарозы равна:
100,520
Осмотическое давление крови росм = 725 кПа, тогда 0,01М раствор глюкозы при 300С можно считать:
гипотоническим
Если  , то понижение температуры замерзания для раствора сахарозы с концентрацией Сm=0,2моль/кг равно:
, то понижение температуры замерзания для раствора сахарозы с концентрацией Сm=0,2моль/кг равно:
0,37º
Осмотическое давление 1л раствора неэлектролита при 25°С равно 2,47кПа, тогда в нем содержится... молей.
0,001
Чтобы повысить температуру кипения воды на 1градус, тогда в 100г воды 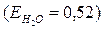 надо растворить С12Н22О11 массой равной:
надо растворить С12Н22О11 массой равной:
65,8г
При 250С осмотическое давление 0,25М раствора мочевины равно:
619 кПа
Если  тогда повышение температуры кипения для раствора сахарозы концентрацией Сm=0,4моль/кг будет равна
тогда повышение температуры кипения для раствора сахарозы концентрацией Сm=0,4моль/кг будет равна
0,21º
Осмотическое давление крови росм = 725 кПа, тогда 0,3 М раствор глюкозы при 25°С считают:
Физиологический раствор по отношению к сыворотке крови является:
изотоническим.
В концентрированном растворе NaCI красные кровяные шарики сморщиваются, при этом происходит явление:
плазмолиза.
Величина ионного произведения воды:
Kw=[H+][OH-]
Формула показателя гидроксильной группы:
pOH= -lg[OH-]
Формула водородного показателя:
рH= -lg[H+]
Константа диссоциации циановодородной кислоты НСN имеет вид:
[H+][CN-]
K= ----------------
[HCN]
Если [H+]=1 * 10-4 моль/л, тогда:
рН=4
Если [H+]=10-3 моль/л, тогда рОН равно:
Если [Н+]=1*10-8 моль/л, тогда концентрация [ОН-] равна:
1*10-6
Закон разведения Оствальда применим для:
разбавленных растворов слабых электролитов.
Формула степени диссоциации:
n число продиссоц-х молекул вещества
a=----------------------------------------------------------------------
N общее число молекул растворенного вещества
Константа диссоциации для кислоты СН3СООН имеет вид:
[H+][CH3COO-]
K=--------------------
[CH3COOH]
Константа диссоциации для НNO2 имеет вид:
[H+][NO2-]
K=---------------
[HNO2]
Ионное произведение воды равно:
Kw=10-14
Если концентрация ионов водорода в растворе равна 10-2 моль/л, тогда:
рН=2.
Если рН=3, тогда концентрация ионов водорода равна:
|
|
|
10-3
Слабый электролит:
H3РО4
Сильный электролит:
КОН
В наиболее широком диапазоне в организме человека может изменяться рН:
желудочного сока.
Фактор, ускоряющий гидролиз – это:
повышение температуры.
Раствор соли К2СО3 показывает... среду.
щелочную
Раствор соли Nа2S показывает... среду.
щелочную
Раствор соли NН4СІ показывает... среду.
кислую
При гидролизе дает нейтральную среду соль:
СН3СООNН4
Гидролизу не подвергается соль:
NаСІ
... Гидролизу не подвергается соль:
Nа2SО4
Соль... подвергается гидролизу и по катиону и по аниону.
СН3СООNН4
Соль... подвергается гидролизу ступенчато.
К3РО4
Соли, образованные... не подвергаются гидролизу.
сильной кислотой и сильным основанием
Буферное действие – это способность:
сохранять рН при добавлении сильной кислоты или основания и при разведении
Буферная система:
NH4OH+NH4Cl
Буферная система:
CH3COOH+CH3COON a
Буферная система:
Na2HPO4+NaH2PO4
Буферная система:
HCOOH+HCOONa
Система, обладающая буферным действием – это раствор:
слабой кислоты и ее соли сильного основания.
Система, обладающая буферным действием – это раствор:
слабого основания и его соли сильной кислоты
Буферная емкость – это:
количество моль-экв. сильной кислоты или сильного основания при добавлении которых к 1л буферной смеси рН изменяется на единицу.
Формула определения зоны буферного действия:
 pH=pK+-1
pH=pK+-1
Если у ацетатного буфера рК=4,75, тогда зона буферного действия будет равна:
рН=3,75-5,75
Если у формиатного буфера рК=3.74, тогда зона буферного действия будет равна:
рН=2,74-4,74
Если у аммиачного буфера рК=4,74, тогда зона буферного действия будет равна:
рН=8,26-10,26
Формула расчета рН ацетатного буфера:
pH=pKк-ты-lg[HA]/[BA]
Формула расчета рН формиатного буфера:
pH=pKк-ты-lg[HA]/[BA]
Формула расчета рН аммиачного буфера:
pH=14-pKосн+lg[BOH]/[BA]
Формула расчета буферной емкости кислотного буфера:
B= a/DpH
Формула расчета буферной емкости основного буфера:
B=b/DpH
Если  равна, тогда ацетатный буфер с рН=5,2 приготовить...
равна, тогда ацетатный буфер с рН=5,2 приготовить...
можно, так как лежит в интервале рН=рК±1.
Если  равна, тогда формиатный буфер с рН=4,5 приготовить...
равна, тогда формиатный буфер с рН=4,5 приготовить...
можно, так как лежит в интервале рН=рК±1.
Если 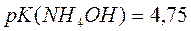 равна, тогда аммиачный буфер с рН=9,25 приготовить...
равна, тогда аммиачный буфер с рН=9,25 приготовить...
можно, так как входит в интервал рН=14-рК±1.
|
|
|
Если  равно, тогда ацетатный буфер с рН=1,8 приготовить...
равно, тогда ацетатный буфер с рН=1,8 приготовить...
нельзя, так как не входит в интервал зоны буферного действия рН=рК±1.
Если рК=7,2 равна, тогда фосфатный буфер с рН=5,7 приготовить...
нельзя, так как не входит в интервал зоны буферного действия рН=рК±1.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1081; Нарушение авторских прав?; Мы поможем в написании вашей работы!