
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
|
|
|
|
Квантование энергии, момента импульса и проекции момента импульса электрона в атоме водорода
Электрон в атоме может иметь только определенные дискретные (квантованные) значения энергии, которые совпадают с выражением
E=-(Z2me4/8ε02h2n2),
где n – главное квантовое число.
2. Орбитальный момент импульса L электрона в атоме также может принимать лишь ряд дискретных значений
L=(h/2π)√l(l+1),
Где l – орбитальное квантовое число.
3. Проекция орбитального момента импульса Lz на выбранное направление OZ (например, направление внешнего магнитного поля) тоже квантуется
Lz=(h/2π)m,
где m – магнитное квантовое число.
Дальнейшие исследования показали, что помимо указанных орбитальных характеристик электрон обладает также собственным моментом импульса Ls.
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения. Частоты спектральных линий для атома водорода и водородоподобных атомов определяются по формуле: v = Rv(1/n2 – 1/n'2), где Rv = Z2me4/8ε02h3 = 3,29 · 1015 с-1 – постоянная Ридберга.
Также эта формула может быть записана через длину волны λ: 1/λ = Rλ(1/n2 – 1/n'2), где Rλ = 1,097 · 107 м-1.
Правила отбора – правила, которые на основе законов сохранения квантовых чисел устанавливают допустимые процессы с участием микросистем (молекул, атомов, ядер, элементарных частиц). Любая микросистема характеризуется определённым набором квантовых чисел. В изолированном состоянии эти квантовые числа у микросистемы остаются неизменными, поскольку являются проявлением соответствующих законов сохранения. Так электрический заряд или полный угловой момент  (момент количества движения) изолированной системы не изменяются, так как существуют законы сохранения электрического заряда и углового момента.
(момент количества движения) изолированной системы не изменяются, так как существуют законы сохранения электрического заряда и углового момента.
В нагретом до высокой температуры водороде можно наблюдать характерный линейчатый спектр. Все спектральные линии группируются в серии в зависимости от того, на какой энергетический уровень переходят электроны.
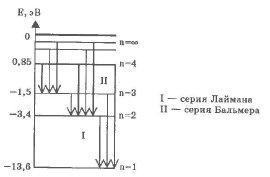
Переходы в первые возбужденные состояния на второй энергетический уровень с верхних уровней образуют серию Бальмера (n = 2), при переходе на первый энергетический уровень с n = 1 образуют серию Лаймана.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2003; Нарушение авторских прав?; Мы поможем в написании вашей работы!