
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбция. Виды адсорбции.Изотерма адсорбции Лэнгмюра.
|
|
|
|
Адсорбция. (важное значение в гетерог. р-циях). А – процесс самопроизвольного увеличения концентрации вещества на границе раздела фаз. Адсорбирующееся в-во – адсорбат, адсорбирующее – адсорбент. Процесс, обратный адсорбции – десорбция. А равновесие определяется 2 процессами: притяжением молекул к пов. под действием межмолекулярных сил и тепловым движением, стремящимся восстановить рав-во концентраций в поверхностном слое и объеме фазы. Количественно хар-ют числом молей или массой в-ва, накапливающегося на гр. раздела фаз, в расчете на ед. площади пов. раздела. А – пов-й процесс, кот. закл. во взаимод. молекул или ионов адсорбата с пов-ю адсорбента за счет сил Ван-дер-Ваалься, водородных связей, электростатических сил. 2 вида А: А на ТВ. пов-ти, А в поверхностном слое жидкости. Физическая адсорбция – обусловленная действием сил В-д-В. Физ. А – обратимый экзотермический процесс (когда частица адс, ее пост. движ огр, уменьш. энтр => для протек. реакции энтальпия должна быть <0, что соотв. экзотермическому процессу). При физ. А быстро устанавливается равновесие между адс. частицами и частицами в газовой фазе. О пов-ой конц. реагентов можно судить по равновесному распределению молекул адсорбата между пов. ТВ. тела и газ. фазой. Это распр. зависит от давления, Т, хим. природы в-в, площади пов-ти. Равновесное распределение оценивают по изотермам адсорбции. Простейшее Ур-ие для Изот. А – Ур-ие изотермы Ленгмюра:  , р – давление, b=ka/kд (константы скор. адсорбции и десорбци). Это Ур-ие определяет долю площади пов., покрытой молекулами в момент равновесия. Зависимость адс. от давления газа (кривая из 0 типа корень, горизонтальная асимптота - q=1). При bp<<1 – Ур-ие изотермы Генри: q=bapa. И наоборот, тогда q~1 – полное заполнение пов-ти. (А не зав. от р – состояние насыщения)., когда а-ют 2 газа
, р – давление, b=ka/kд (константы скор. адсорбции и десорбци). Это Ур-ие определяет долю площади пов., покрытой молекулами в момент равновесия. Зависимость адс. от давления газа (кривая из 0 типа корень, горизонтальная асимптота - q=1). При bp<<1 – Ур-ие изотермы Генри: q=bapa. И наоборот, тогда q~1 – полное заполнение пов-ти. (А не зав. от р – состояние насыщения)., когда а-ют 2 газа 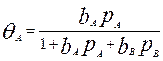 , аналогично для В. Хим. А: процесс А, кот. протекает в рез. обр-ия хим. связи (обычно ковалентной). Е связи адсорбент-адсорбат достаточно велика и прим. = энтальпии образования хим. соединений (80…800кДж/моль). Хаар-ся высокой специфичностью. (кол-во хемос-го в-ва оч чувств-но к хим. прир. адсорбента).
, аналогично для В. Хим. А: процесс А, кот. протекает в рез. обр-ия хим. связи (обычно ковалентной). Е связи адсорбент-адсорбат достаточно велика и прим. = энтальпии образования хим. соединений (80…800кДж/моль). Хаар-ся высокой специфичностью. (кол-во хемос-го в-ва оч чувств-но к хим. прир. адсорбента).
|
|
|
Отличие хемодс. от физ. А – в рез. обр. более прочн. связей хемос. в-во с трудом удаляется с адсорбента, причем десорбция может сопр-ся хим. превращениями. Замедленность реальных проц. А объясняют представлением об акт-ой А, треб-ей, как и ХР некоторой Еа. Поэтому хемосорб. с измеримой скор. может. осущ. в опред. Т интервале. Энергетическая диаг. А процесса – зависимость Е взаим. частиц адсорбата и адсорбента от коорд. проц. х(расст. от пов. адсорбента): при больш. хо пред-ю роль играют силы межмолек. взаим., происх. физ. А, кот. всегда протек. с 0-й Еа. При дальнейшем сближ. частиц. адсорбента и адсорбата нач. преобл. силы хим. взаимод. с обр. хим. св (хемосорбция). Подобно ХР хемос. может осущ. со значит. Еа. Если Еа=0, хемос. наз. неактивированной. Дальше десорбция –активированный процесс (Ед – энергия активации десорбции).
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1799; Нарушение авторских прав?; Мы поможем в написании вашей работы!