
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Валентность. Составление химических формул по валентности
|
|
|
|
Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и немолекулярное строение вещества. Относительная атомная и молекулярная масса. Закон сохранения массы, его значение в химии. Моль – единица количества вещества. Молярная масса. Закон Авогадро и молярный объем газа. Относительная плотность вещества.
Предмет химии. Явления химические и физические.
Химия - это наука о веществах и их превращениях. Она изучает состав и строение веществ, зависимость их свойств от строения, условия и способы превращения одних веществ в другие.
Химия имеет большое практическое значение. Много тысячелетий тому назад человек использовал химические явления при выплавке металлов из руд, получении сплавов, варке стекла и т. д. Ещё в 1751г. М.В. Ломоносов в своём знаменитом «Слове о пользе химии» писал: «Широко распростирает химия руки свои в дела человеческие. Куда ни посмотрим, куда не оглянёмся - везде обращаются перед очами нашими успехи её применения.»
В наше время роль химии в жизни общества неизмерима. Химические знания сейчас достигли такого уровня развития, что на их основе коренным образом меняются представления о природе и механизме ряда важнейших естественных и технологических процессов. Химия помогла нам открыть и использовать не только ранее неизвестные свойства веществ и материалов, но и создать новые, не существующие в природе вещества и материалы.
Вещество - это вид материи, обладающей при определённых условиях постоянными физическими свойствами. Однако с изменением условий свойства вещества изменяются.
Всякие изменения, происходящие с веществом, называются явлениями. Явления бывают как физические, так и химические.
|
|
|
Физическими называются такие явления, которые приводят к изменению формы, агрегатного состояния, температуры вещества, не изменяя его состава. Химический состав вещества в результате физического явления не изменяется. Например, воду можно превратить в лёд, в пар, но её химический состав при этом остаётся прежним.
Химическими называются такие явления, при которых происходит коренное изменение состава и свойств веществ. В результате химических явлений происходит превращение одних веществ в другие, т.е. изменяется состав молекул, образуются молекулы другого вещества. Однако атомы при химических реакциях остаются неизменными. Примером может служить разложение известняка:
CaCO3 → CaO + CO2
Химические явления иначе называют химическими реакциями. Характерные признаки химических явлений (реакций): выделение тепла, газа, выпадение осадка, изменение цвета, появление запаха. При физических явлениях этого наблюдать нельзя.
Теоретическую основу современной химии составляет атомно-молекулярное учение.
Атомы – мельчайшие химические частицы, являющиеся пределом химического разложения любого вещества.
Химический элемент представляет собой вид атомов с одинаковым положительным зарядом ядра.
Следовательно, атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства. В настоящее время известно 110 элементов, из которых 92 встречаются в природе.
В зависимости от природы частиц, из которых построено вещество, различают вещества с молекулярной и немолекулярной структурой. Практически все органические вещества (т.е. подавляющее большинство известных веществ) состоят из молекул. Среди неорганических соединений молекулярное строение имеют примерно 5%. Таким образом, наиболее типичной формой существования вещества является молекула.
Молекула – наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его основные химические свойства.
|
|
|
При обычных условиях вещества с молекулярной структурой могут находиться в твердом, жидком или газообразном состоянии. Вещества с немолекулярной структурой находятся только в твердом состоянии, преимущественно в кристаллической форме. Носителями химических свойств таких веществ являются не молекулы, а комбинации атомов или ионов которые образуют данное вещество.
Символическая запись простейшего численного соотношения, в котором атомы различных элементов образуют химическое соединение, называется формулой. Следовательно, формула выражает определенный (качественный и количественный) состав соединения. Так, SO2, N2, CO - формулы веществ, имеющих молекулярное строение. Их состав всегда строго постоянен. NaCl, AlF3, ZnS– формулы веществ, не имеющих молекулярное строение при обычных условиях. Состав таких веществ не всегда постоянен и часто зависит от условия их получения. Отклонение от целочисленного соотношения могут быть выражены при записи формулы: Fe0,9S, TiO0,7, ZrN0,69. Вещества с постоянным составом называются дальтонидами, вещества с переменным составом – бертоллидами.
Массы атомов химических элементов чрезвычайно малы. В химии пользуются не их абсолютными значениями, а относительными.
Относительной атомной массой химического Ar элемента называется величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 1\12 массы изотопов углерода – 12. 1\12 массы атома изотопа углерода 12 принята за атомную единицу массы (а. е. м.), международное обозначение - u.
Относительная атомная масса является величиной безразмерной.
Относительной молекулярной массой Mr вещества называется отношение массы его молекулы к 1\12 массы атома изотопа углерода 12.
Поскольку большинство неорганических веществ при обычных условиях не имеют молекулярного строения, в данном случае можно говорить о формульной массе F, понимая под ней сумму атомных масс всех элементов, входящих в соединение, с учетом числа атомов каждого элемента в формуле.
Единицей измерения количества вещества n (ν) в Международной системе единиц является моль.
|
|
|
Моль – количество вещества, содержащее столько структурных элементарных единиц (атомов, ионов, молекул, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12.
Число атомов NA в 0,012 кг углерода (т.е. в 1моль) легко определить, зная массу атома углерода. Точное значение этой величины – 6,02·10²³. Эта величина называется постоянной Авогадро и является одной из важнейших универсальных постоянных. Она равна числу структурных единиц в 1 моль любого вещества.
Масса 1 моль вещества Х называется молярной массой М(Х) и представляет собой отношение массы m этого вещества к его количеству n.
Закон сохранения массы: «Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции, с учетом массы, соответствующей тепловому эффекту реакции». Он был сформулирован великим русским ученым М.В.Ломоносовым в 1748г. и подтвержден экспериментально им самим в 1756г. и независимо от него французским химиком А.Л.Лавуазье в 1789г.
Закон постоянства состава вещества: «Любое сложное вещество молекулярного строения независимо от способа получения имеет постоянный количественный состав».
Закон Авогадро: «В равных объемах различных газов при одинаковых условиях содержится одно и то же количество молекул».
Следствия: 1. Если число молекул некоторых газов равно, то при н.у. они занимают равные объемы. Если же число молекул равно 6,02·10²³, то объем газа равен 22,4 л. Этот объем называется молярным объемом.
1. Абсолютная плотность газа равна отношению его молекулярной массы к молярному объему
2. Относительная плотность газа (Х) по другому газу (Y) равна отношению молярной массы газа (Х) к молярной массе газа (Y).
Уравнение Клаперона:
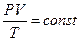 | 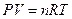 | 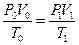 | |||
Уравнение Менделеева-Клаперона:
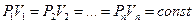 |
Уравнение Бойля-Мариотта:
Уравнение Шарля-Гей-Люсака:
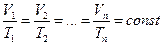 |
Химический элемент. Простые и сложные вещества. Химические формулы.
Вид атомов с одинаковыми химическими свойствами называется элементом. Атомы одного и того же элемента могут отличаться только массой. Химические свойства у них одинаковы. Существуют разновидности атомов одного и того же элемента, называемые изотопами.
|
|
|
Понятие «химический элемент» в равной мере относится к атомам данного элемента как находящимся в свободном виде, так и входящим в состав соединений.
Молекулы образуются из атомов. В зависимости от того, состоит ли молекула из атомов и того же элемента или из атомов различных элементов, все вещества делятся на простые и сложные.
Простыми веществами называются такие, молекулы которых состоят из атомов одного элемента. Молекулы простых веществ могут состоять из одного, двух и большего числа атомов одного элемента. В настоящее время является неоспоримым факт существования одного и того же элемента в свободном состоянии в виде ряда различных форм, т.е. в виде нескольких простых веществ.
Существование элемента в виде нескольких простых веществ называется аллотропией. Простые вещества, образованные одним и тем же элементом, называются аллотропическими видоизменениями этого элемента. Эти видоизменения отличаются как числом, так и расположением одних и тех же атомов в молекуле.
Сложными веществами или химическими соединениями называются такие, молекулы которых состоят из атомов двух или более элементов. Атомы, вступившие в химическое соединение, не остаются неизменными. Они оказывают друг на друга взаимное влияние. В различных молекулах атомы находятся в различных состояниях.
Химическая формула – это изображение состава вещества посредством химических знаков. Химические формулы обозначают молекулу вещества, ее качественный и количественный состав.
Важным понятием химии является валентность. Валентность – способность атома соединяться с другими атомами определенным числом химических связей. Числовое значение валентности определяется общим числом атомных орбиталей, участвующих в образовании химической связи:
| ↑↓ | ↑ | ↑ | |
| ↑ | ↑ | ↑↓ | ↑↓ |
СО: С≡О С: 1s22s22p2 валентность:3
O: 1s22s22p4
Все сказанное относится к соединениям с ковалентной связью. Если элемент образует ионные связи, то его валентность называется стехиометрической. Она ничего не говорит о числе связей. Высшая валентность равна номеру группы, в которой находится элемент, однако N, O и F имеют высшую валентность – 4. Это объясняется тем, что атомы этих элементов не могут переходить в возбужденное состояние из-за отсутствия вакантных орбиталей на ВЭУ.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1233; Нарушение авторских прав?; Мы поможем в написании вашей работы!