
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Растворимость веществ. Зависимость растворимости от их природы, температуры и давления. Массовая доля растворенного вещества в растворе
|
|
|
|
Раствором называют гомогенную систему переменного состава, состоящую из двух и более компонентов. Каждый из компонентов раствора равномерно распределен в массе другого в виде молекул, атомов или ионов. Растворы бывают газообразные, жидкие и твердые. Практически наиболее важны жидкие растворы. Условно компоненты раствора делятся на растворенные вещества и растворитель. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем является тот компонент, агрегатное состояние которого не меняется при образовании раствора. При растворении происходит взаимодействие растворенного вещества и растворителя, называемое сольватацией, в случае водных растворов – гидратацией. Растворение в жидкостях газов и жидкостей сопровождается обычно выделением теплоты (ΔH<0); растворение твердых веществ в большинстве случаев – процесс эндотермический (ΔH>0). Энтропия при растворений твердых веществ, как правило, увеличивается (ΔS>0), газов – уменьшается (ΔS<0).
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества приданных условиях является содержание его в насыщенном растворе. Раствор называется насыщенным, если он находится в равновесии с растворяемым веществом (ΔG=0), т.е. в насыщенном растворе содержится предельное при данных условиях количество растворенного вещества. Раствор, содержащий вещества больше, чем это определяется его растворимостью, - пересыщенный, раствор, содержащий вещества меньше, чем это определяется его растворимостью, - ненасыщенный. На практике растворимость твердых веществ часто выражают величиной, называемой коэффициентом растворимости, который показывает массу безводного вещества, насыщающую 100 г растворителя при данной температуре. Растворимость вещества зависит от природы растворяемого вещества и растворителя, их агрегатного состояния, наличия в растворе посторонних веществ, температуры, а в случае газообразного растворяемого вещества – и от давления. Согласно правилу «подобное растворяется в подобном», ионные соединения и молекулярные с полярным типом связи лучше растворяются в полярных растворителях, неполярные вещества – в неполярных растворителях. При повышении температуры растворимость газов обычно уменьшается. Растворимость твердых веществ меняется по-разному, что определяется знаком теплового эффекта процесса растворения: растворение большинства твердых веществ – процесс эндотермический (ΔH>0), поэтому с повышением температуры растворимость их увеличивается. Влияние давления на растворимость газов в жидкостях выражает закон Генри:
|
|
|
| Растворимость газа при постоянной температуре прямо пропорционально его парциальному давлению над раствором: x = k∙p |
где x – молярная доля растворенного вещества в насыщенном растворе; k – коэффициент пропорциональности, называемый константой (коэффициентом) Генри; р – парциальное давление.
Закон Генри справедлив для случая сравнительно разбавленных растворов, невысоких давлений и отсутствия химического взаимодействия между молекулами растворяемого газа и растворителя.
Присутствие посторонних веществ, как правило, уменьшает растворимость данного вещества. Уменьшение растворимости веществ в присутствии солей называется высаливанием. Растворимость малорастворимых электролитов уменьшается при введении в насыщенный раствор одноименных ионов.
|
|
|
На практике состав растворов выражают с помощью следующих величин: безразмерных – массовая и молярная доли и размерных – молярная концентрация вещества, молярная концентрация вещества эквивалента, моляльность и массовая концентрация вещества.
Массовая доля растворенного вещества w – отношение массы растворенного вещества m1 к общей массе m:
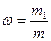
Массовая доля выражается в процентах и в долях единицы.
Молярная доля i-го компонента раствора xi – отношение количества вещества данного компонента к общему количеству вещества раствора. Для бинарного раствора:
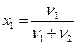
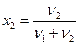
Молярная доля также выражается в процентах и в долях единицы.
Моляльность раствора b(X) – отношение количества растворенного вещества Х к массе растворителя m:
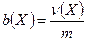
Моляльность выражается в моль/кг.
Молярная концентрация вещества в растворе частиц Х с(Х) – отношение количества вещества к объему раствора:
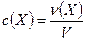
Молярная концентрация выражается в моль/л.
Молярная концентрация вещества эквивалента (1/z*)X в раствореc[ (1/z*)X ] – отношение количества растворенного вещества эквивалента (1/z*)Xк объему раствора:
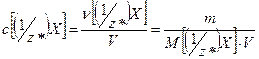
Она выражается в моль/л.
Массовая концентрация вещества Х в растворе Т(Х) – отношение массы растворенного вещества Х к объему раствора:
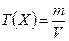
Массовая концентрация выражается в г/л.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2675; Нарушение авторских прав?; Мы поможем в написании вашей работы!