КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Напрямок перебігу окисно-відновних реакцій
|
|
|
|
Під час безпосередньої взаємодії реагуючих речовин окисно-відновна реакція буде відбуватися в тому ж напрямку, як і у гальванічному елементі.
Таким чином, якщо співставити значення потенціалів відповідних електродів, можна визначити напрямок перебігу окисно-відновної реакції.
Рівняння рівноважних електродних процесів наведені в таблицях Д.6 та Д.7. В цих рівняннях окиснена форма учасника електродного процесу (Ох) знаходиться зліва від знаку оборотності, а його відновлена форма (Red) – справа. Крім того, в прямому напрямку (→) відбувається відновлення (приєднання електронів), а у зворотному (←) – окиснення (віддавання електронів):
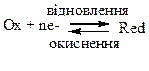
Приклад 1. Визначте напрямок перебігу окисно-відновних реакцій, рівняння яких наведені нижче:
а) SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2;
б) I2 + Pb(NO3)2 + 2KNO3 + 2H2O = 2KI + PbO2 + 4НNO3;
в) Fe + 2FeCl3 = 3FeCl2
Розв’язання. Запишемо рівняння реакції а) у йонному вигляді, враховуючи, що всі солі, що беруть участь в реакції розчинні у воді і повністю дисоціюють на йони. Виключаємо з обох частин рівняння однакові йони, тобто йони Cl–, і отримаємо остаточне рівняння реакції:
Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ (11.1)
Гальванічний елемент, в якому відбувається така струмоутворююча реакція, складається з двох редокс-електродів.
Схема ГЕ:
Pt | Sn2+, Sn4+ || Fe3+, Fe2+ | Pt
Виписуємо рівняння рівноважних електродних процесів в такому ж вигляді, як вони наведені у таблиці Д.7: зліва знаходиться окиснена форма елементів (Sn4+, Fe3+), а справа – їх відновлена форма (Sn2+, Fe2+). Ступінь окиснення атомів елементів в окисненій формі більший за їх ступінь окиснення у відновленій формі. Поруч зазначаємо стандартні потенціали цих редокс-електродів:
(І) Sn4+ + 2e–  Sn2+, φ0 Sn4+, Sn2+ | Pt = + 0,15 В;
Sn2+, φ0 Sn4+, Sn2+ | Pt = + 0,15 В;
(ІІ) Fe3+ + e–  Fe2+, φ0 Fe3+, Fe2+ | Pt = + 0,77 В
Fe2+, φ0 Fe3+, Fe2+ | Pt = + 0,77 В
|
|
|
Оскільки φ0 Sn4+, Sn2+ | Pt < φ0 Fe3+, Fe2+ | Pt, то це означає, що електрод з меншим потенціалом, тобто редокс-електрод (І), є анодом, на якому відбувається окиснення (віддавання електронів). Редокс-електрод (ІІ), тобто електрод з більшим потенціалом, є катодом, на якому відбувається відновлення (приєднання електронів).
Тому записуємо рівняння електродного процесу (І) у зворотному напрямку, а процесу (ІІ) – у прямому напрямку:
(І) Sn2+ – 2e– = Sn4+ | 1
(ІІ) Fe3+ + e– = Fe2+ | 2
Складаючи ліві частини рівнянь обох процесів та їх праві частини, попередньо помноживши рівняння процесу (ІІ) на 2, одержуємо рівняння сумарної реакції, яка є струмоутворюючою у ГЕ, що розглядається:
Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+
Оскільки рівняння сумарної реакції співпадає з рівнянням (11.1), робимо висновок, що реакція а) відбувається у прямому напрямку.
Для підтвердження висновку розрахуємо електрорушійну силу гальванічного елемента, як різницю потенціалів редокс-електродів:
Е0 = φ0 катода – φ0 анода = φ0 Fe3+, Fe2+| Pt – φ0 Sn4+, Sn2+ | Pt = 0,77 – 0,15 = 0,69 В
Додатна величина електрорушійної сили цього ГЕ свідчить: висновок про напрямок перебігу окисно-відновної реакції а) вірний.
Запишемо рівняння реакції б) в йонно-молекулярному вигляді. Оскільки PbO2 – нерозчинна у воді речовина, H2O – слабкий електроліт, а I2 – неелектроліт, то ці речовини слід записувати у вигляді молекул. Кислота НNO3 – сильний електроліт, солі Pb(NO3)2, KNO3 і KI розчинні у воді і тому повністю дисоціюють на йони. Після виключення йонів К+ та NO3– з обох частин рівняння одержуємо остаточне рівняння реакції:
I2 + Pb2+ + 2H2O = 2I– + PbO2 + 4H+ (11.2)
Така струмоутворююча реакція відбувається у гальванічному елементі, який також складається з двох редокс-електродів. Виписуємо з таблиці Д.7 рівняння рівноважних електродних процесів та стандартні потенціали відповідних редокс-електродів:
(І) I2 + 2e–  2I–, φ0 (І)= 0,53 В;
2I–, φ0 (І)= 0,53 В;
|
|
|
(ІІ) PbO2 + 4H+ + 2e–  Pb2+ + 2H2O, φ0 (ІІ)= +1,45 В
Pb2+ + 2H2O, φ0 (ІІ)= +1,45 В
Порівнюємо стандартні потенціали цих редокс-електродів:
φ 0 (І) < φ0 (ІІ)
Отже, електрод з меншим потенціалом, тобто редокс-електрод (І), є анодом, на якому відбувається окиснення (віддавання електронів). Тому рівняння електродного процесу (І) запишемо у зворотному напрямку:
2I– – 2e– =I2
Електрод з більшим потенціалом, тобто редокс-електрод (ІІ), є катодом, на якому відбувається відновлення (приєднання електронів), і електродний процес (ІІ) запишемо у прямому напрямку:
PbO2 + 4H+ + 2e– = Pb2+ + 2H2O
Сумарне рівняння окисно-відновної реакції б) одержуємо, складаючи ліві частини рівнянь електродних процесів та їх праві частини:
2I– + PbO2 + 4H+ = I2 + Pb2+ + 2H2O
Порівнюючи сумарне рівняння з рівнянням (11.2), робимо висновок, що окисно-відновна реакція б) відбувається у зворотному напрямку.
Розрахуємо стандартну електрорушійну силу ГЕ, який складається з цих редокс-електродів:
Е0 = φ0 катода – φ0 анода = φ0 (ІІ) – φ0 (І) = 1,45 – 0,53 = 0,93 В
Оскільки Е0>0, то висновок про напрямок перебігу окисно-відновної реакції б) зроблений вірно.
Йонно-молекулярне рівняння реакції в) одержуємо, беручи до уваги, що розчинні у воді солі FeCl3 та FeCl2 повністю дисоціюють на йони, і виключаючи з обох частин рівняння йони Cl–:
Fe + 2Fe3+ = 3Fe2+ (11.3)
Гальванічний елемент, в якому відбувається така струмоутворююча реакція, складається з двох електродів, один з яких є металічним, а інший – редокс-електродом.
Схема ГЕ:
Fe | Fe2+ || Fe3+, Fe2+ | Pt
Виписуємо з таблиці Д.6 рівняння рівноважного електродного процесу (І) та стандартний потенціал металічного електрода:
(І) Fe2+ + 2e–  Fe0 , φ0 Fe2+|Fe = – 0,44 В;
Fe0 , φ0 Fe2+|Fe = – 0,44 В;
а з таблиці Д.7 рівняння рівноважного електродного процесу (ІІ) і стандартний потенціал редокс-електрода:
(ІІ) Fe3+ + e–  Fe2+, φ0 Fe3+, Fe2+|Pt = 0,77 В.
Fe2+, φ0 Fe3+, Fe2+|Pt = 0,77 В.
Порівнюючи стандартні потенціали цих електродів (φ0 Fe2+|Fe <φ0 Fe3+, Fe2+|Pt), робимо висновок, що анодом є металічний електрод, і електродний процес (І), тобто окиснення, відбувається у зворотному напрямку:
Fe – 2e– = Fe2+ | 1
Катодом є редокс-електрод, тому електродний процес (ІІ), тобто відновлення, відбувається у прямому напрямку:
Fe3+ + e– = Fe2+ | 2
Сумарне рівняння, тобто рівняння струмоутворюючої реакції цього ГЕ, одержуємо, складаючи рівняння електродних процесів, попередньо помноживши рівняння процесу (ІІ) на 2:
|
|
|
Fe + 2Fe3+ = 3Fe2+
Оскільки сумарне рівняння співпадає з рівнянням (11.3), то це свідчить про те, що окисно-відновна реакція в) відбувається в прямому напрямку.
Розрахуємо стандартну електрорушійну силу цього ГЕ:
Е0 = φ0 катода – φ0 анода = φ0 Fe3+, Fe2+|Pt – φ0 Fe2+|Fe = 0,77 – (– 0.44) = 1,21 В
Оскільки Е0>0, то висновок про напрямок перебігу окисно-відновної реакції в) зроблений вірно.
Приклад 2. Який процес – окиснення чи відновлення – відбувається в такому перетворенні: Н2О2 → Н2О? Які з речовин: KF, KI, H2S – можна використати для здійснення перетворення?
Розв’язання. Ступінь окиснення атомів оксигену в молекулі Н2О2 дорівнює “–1”, а в молекулі Н2О – “–2”. Отже, в наведеному в умові перетворенні відбувається відновлення, тобто приєднання електронів атомами оксигену в молекулі гідроген пероксиду.
Виписуємо з таблиці Д.7 стандартний потенціал редокс-електрода, на якому здійснюється рівноважний електродний процес за таким рівнянням:
Н2О2 +2Н+ + 2e–  2Н2О, φ0 = + 1,78 В.
2Н2О, φ0 = + 1,78 В.
Для того, щоб визначити, чи здатні окиснюватись аніони: F–, I– та атоми S2– у розчинах сполук KF, KI, H2S, тобто сприяти відновленню Н2О2, потрібно порівняти стандартний потенціал розглянутого редокс-електрода (+1,78 В) зі стандартними потенціалами редокс-електродів, на яких відбуваються рівноважні електродні процеси за участю речовин, вказаних в умові (Табл. Д.7):
F2 + 2e–  2F–, φ0 = + 2,84 В;
2F–, φ0 = + 2,84 В;
I2 + 2e–  2I–, φ0 = + 0,53 В;
2I–, φ0 = + 0,53 В;
S + 2H+ + 2e–  H2S, φ0 = + 0,14 В
H2S, φ0 = + 0,14 В
Оскільки потенціал редокс-електрода, на якому відбувається окиснення, повинен бути менше, ніж +1,78 В, то робимо висновок: для здійснення відновлення в перетворенні Н2О2 → Н2О можна використати речовини KI та H2S, які окиснюються за рівняннями:
2I– – 2e– = I2
H2S – 2e– = S + 2H+
Приклад 3. Який процес – окиснення чи відновлення – відбувається в такому перетворенні: NO → НNО2? Які з речовин: SnCl4, MnO2 – можна використати для здійснення перетворення?
Розв’язання. Ступінь окиснення атомів нітрогену в молекулі NO дорівнює “+2”, а в молекулі НNО2 – “+3”. Таким чином, внаслідок цього перетворення атоми нітрогену віддають електрони, тобто окиснюються.
|
|
|
Виписуємо з таблиці Д.7 стандартний потенціал редокс-електрода, на якому здійснюється рівноважний електродний процес за таким рівнянням:
HNO2 + Н+ + e–  NO + Н2О, φ0 = + 0,99 В
NO + Н2О, φ0 = + 0,99 В
Стандартний потенціал розглянутого електрода повинен бути меншим за стандартні потенціали наведених нижче редокс-електродів (Табл. Д.7):
Sn4+ + 2e–  Sn2+, φ0 = + 0,15 В;
Sn2+, φ0 = + 0,15 В;
MnO2 + 4H+ + 2e–  Mn2+ + 2H2O, φ0 = + 1,23 В
Mn2+ + 2H2O, φ0 = + 1,23 В
Отже, для здійснення процесу окиснення за таким рівнянням:
NO + Н2О – e–  HNO2 + Н+
HNO2 + Н+
можна використати лише речовину MnO2.
12. КОРОЗІЯ МЕТАЛІВ ТА СПЛАВІВ
Корозія металів – це руйнування металів та сплавів під час їх взаємодії з навколишнім середовищем. Продуктами корозії є оксиди, гідроксиди або солі, які містять атоми металів з позитивним ступенем окиснення. Отже, корозія - це процес окиснення металів, тобто іх перехід з вільного до окисненого стану:
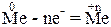
Енергія Гіббса утворення продуктів корозії – величини від'ємні, а енергія Гіббса утворення металів у вільному стані дорівнює нулю, тому перетворення металів на їх сполуки супроводжується зменшенням енергії Гіббса (∆G<0) і відбувається довільно. Отже, причина корозії - термодинамічна нестабільність металів у вільному стані у навколишньму середовищі.
За характером руйнування металів розрізняють такі типи корозіі:
1. Рівномірна корозія, яка рівномірно охоплює всю поверхню металу.
2. Місцева корозія – зосереджена на окремих ділянках поверхні металу. Місцеву корозію за виглядом iї осередків поділяють на плямисту, точкову та найбільш небезпечну – пітингову корозію, коли осередки корозії мають вигляд булавочних уколів.
3. Міжкристалітна корозія – уражає метал на межі між кристалітами.
4. Транскристалітна корозія – проходить крізь всі кристаліти.
5. Селективна корозія – уражає один з компонентів сплавів.
Класифікація процесів корозії за механізмом їх перебігу
І. Хімічна корозія. Хімічна корозія відбувається у неструмопровідному середовищі, а саме, у рідких неелектролітах або внаслідок дії на метал сухих агресивних газів (Н2S, O2, SO2 тощо) за високих температур, що виключають утворення плівки вологи на поверхні металів. Наприклад, корозія двигунів внутрішнього згоряння, деталей турбін, ракетних двигунів, окиснення металів в печах, домнах тощо.
Для сплавів важливою є також різниця у швидкості окиснення їх компонентів. Це призводить до зміни складу сплавів, що впливає на їх фізичні властивості. Особливо небезпечним є зменшення внаслідок корозії вмісту карбону, який містить сталь у вигляді ферум карбіду Fe3C. Своєю твердістю сталь зобов'язана саме присутності Fe3C у своєму складі. За нагрівання сталі атоми карбону під дією O2 та СО2 окиснюються швидше, ніж атоми феруму:
2 Fe3C + O2 = 6 Fe + 2 CO,
Fe3C + CO2 = 3 Fe + 2 CO.
Вміст атомів карбону на поверхні сталі зменшується і тверда сталь перетворюється на м'яке залізо.
Отже, в основі хімічної корозії – звичайні хімічні окисно-відновні реакції. Тобто процес хімічної корозії не пов'язаний з електричним струмом.
2. Електрохімічна корозія. Процес електрохімічної корозії пов'язаний з електричним струмом і відбувається у струмопровідному середовищі, тобто, якщо металічний виріб перебуває у водному розчині або на його поверхні утворюється плівка вологи. Отже, механізм електрохімічної корозії можна розглядати як перебіг анодного та катодного процесів, які відбуваються у корозійному гальванічному елементі (ГЕ), що виникає довільно. На аноді корозійного ГЕ відбувається окиснення металу:
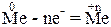 . (12.1)
. (12.1)
Роль катода відіграють метали з більшим електродним потенціалом; неметалічні домішки (наприклад, Fe3C у складі сталі); менш деформовані, більш збагачені киснем ділянки поверхні металу, пориста та ушкоджена оксидна плівка. На катоді відбувається відновлення компонентів навколишнього середовища, а саме йонів Н+ чи атомів гідрогену води Н+ОН або, якщо у середовищі присутній кисень, то відновлення атомів оксигену, що складають молекули О2:
а) у відсутності кисню:
– у кислому середовищі (рН < 7, [Н+]>[ОН-]):
2H+ + 2e- = H2, (12.2)
– у нейтральному та лужному середовищі (рН ≥ 7):
2Н+ОН + 2е- = Н2 + 2ОН- (12.3)
Хоча у лужному середовищі (pH>7) існують переважно йони ОН– ([ОН–]>[Н+]), але ці аніони не здатні приєднувати електрони, тому у лужному середовищі, як і у нейтральному (рН=7, [ОН–]=[Н+]), на катоді відновлюються атоми гідрогену, що містяться у молекулах води.
б) за наявності кисню:
– у кислому середовищі (рН < 7):
O2 + 4H+ + 4e- = 2H2O, (12.4)
– у нейтральному та лужному середовищі (рН ≥ 7):
O2 + 2Н2O + 4e- = 4ОН-. (12.5)
Умова перебігу корозії: потенціал анодного процесу, тобто потенціал окиснення металу (потенціал металічного електрода j Меn+/Me), повинен бути меншим, ніж потенціал процесу відновлення, який відбувається на катоді корозійного ГЕ.
Потенціал процесу відновлення гідрогену розраховуємо за рівнянням Нернста для водневого електрода (10.8):
j H+/H2 = – 0,059рН,
а потенціал процесу відновлення кисню – за рівнянням Нернста для кисневого електрода (10.9):
j ОH–/О2 = 1,23 – 0,059рН.
Залежність потенціалів водневого та кисневого електродів від рН розчинів наведена на малюнку:
|
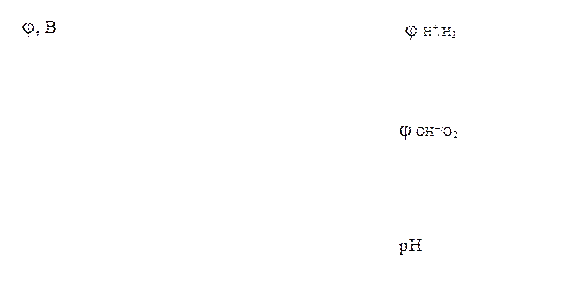
Якщо потенціал металу менший і за потенціал водневого, і за потенціал кисневого електродів:
j Меn+/Me < j H+/H2 , катод,
j Меn+/Me < j ОH–/О2, катод,
то метал кородує у будь-якому середовищі, тобто і за наявності кисню, і у його відсутності (зона І).
Якщо потенціал металу більший за потенціал водневого електрода, але менший за потенціал кисневого електрода:
j H+/H2, катод < j Меn+/Me < j ОH–/О2, катод,
то корозія металу відбувається тільки за наявності кисню у навколишньому середовищі (зона 2).
Якщо потенціал металу більший за потенціал як кисневого, так і водневого електродів:
j Меn+/Me > j H+/H2, катод,
j Меn+/Me > j ОH–/О2, катод,
то корозія металу неможлива (зона 3).
Фактори, що сприяють корозії
І. Контакт металів різної природи:
а) у приладах та механізмах - це контакт деталей, вироблених з різних металів,
б) у технічних металах - це контакт основного металу з домішками інших металів,
в) у сплавах - це контакт різних компонентів сплавів.
Роль анода у таких корозійних ГЕ відіграє метал з меншим електродним потенціалом.
2. Пори та ушкодження оксидної плівки, що вкриває поверхню металу. Катодом корозійного ГЕ є оксидна плівка, а оголена поверхня металу – анодом, тобто внаслідок корозії руйнується метал.
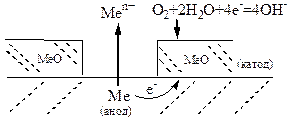
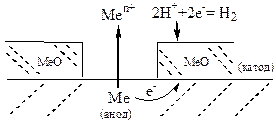
3. Механічні деформації, що виникають внаслідок обробки металу. При контакті двох ділянок металу – деформованого та недеформованого – виникає корозійний ГЕ, анодом якого е деформована ділянка металу. Саме тому поламки металічних виробів відбуваються у місцях пресувань, свердління, витягування тощо.
4. Неметалічні включення у складі металу. Наприклад, сталь містить включення ферум карбіду Fe3C. Ці включення під час корозії сталі є катодами, а основний метал, тобто залізо, виступає у ролі анода.
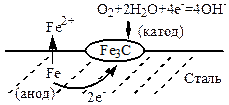
5. Нерівномірне постачання кисню повітря до поверхні металу.
Якщо на поверхні металу знаходяться сторонні частинки, наприклад, такі, як крапельки вологи, бульбашки будь-якого газу, частинки бруду, то під ними швидко вичерпується кисень повітря. Ці ділянки поверхні металу є анодами корозійних ГЕ, а більш забезпечені киснем ділянки є катодами. Оскільки площа поверхні анода набагато менша за площу поверхні катода, густина корозійного струму на анодних ділянках значно збільшується. Через те, що розчинення металу зосереджується на маленькій площі поверхні металу, осередки корозії мають вигляд булавочних уколів (пітингова корозія).
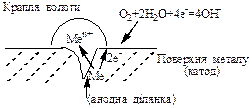
Розглянутий фактор сприяє корозії металічних виробів (труб, нафтопроводів, будівельних конструкцій тощо) у грунті, якщо грунт нерівномірно прилягає до поверхні металу. Та частина поверхні металу, що відокремлена від грунту прошарком повітря, стає катодом, а руйнується та частина поверхні металу, до якої щільно прилягає грунт, що утруднює доступ повітря. Тому ж виникає корозія металу і на межі між сухим та вологим грунтом, який на відміну від сухого погано пропускає повітря.
Способи захисту від корозії
Корозія завдає дуже великої шкоди народному господарству. Близько 10% щорічного видобутку металів іде на поповнення втрат від корозії. Але шкода від корозії не обмежується тільки втратою металу внаслідок його окиснення. Достатньо виникнення навіть маленької дірки у паровому котлі, приладі чи хімічному устаткуванні і вся споруда стає непридатною до експлуатації. Крім того, внаслідок корозії втрачаються такі цінні властивості металів, як міцність, пластичність, погіршуються їх електричні, магнітні властивості, змінюються розміри деталей, порушується герметичність апаратів тощо. Тому найважливішим завданням є захист металів від корозіі.
В залежності від характеру корозії та умов її перебігу використовують різні способи захисту від корозіі. Вибір того чи іншого способу визначається його ефективністю у кожному конкретному випадку, а також економічною доцільністю його використання.
І. Через те, що корозія металічних виробів починається з їх поверхні, велике значення надають захисним покриттям, тобто ізоляції поверхні металу від зовнішнього середовища. Розрізняють такі захисні покриття:
а) хімічні покриття, які створюють обробкою поверхні металу різними хімічними реагентами, внаслідок чого утворюються поганорозчнні, стійкі до корозії сполуки. За своїм складом захисні покриття поділяють на оксидні, фосфатні, хроматні тошо. Створення на поверхні металу оксидного покриття називається оксидуванням. Найкращим захисним покриттям на поверхні алюмінію та його сплавів є оксидна плівка. Щоб запобігти корозії сталі, застосовують її фосфатування, яке полягає в створенні на поверхні сталевих виробів плівки ферум фосфатів та манган фосфатів.
б) неметалічні покриття, до яких належать лаки, фарби, емалі, мастила тощо.
в) металічні покриття, тобто шар певного металу на поверхні металічного виробу. Якщо потенціал металу покриття більший за потенціал металу виробу, то таке покриття називається катодним. Прикладом катодного покриття на сталевих виробах (основний метал – залізо) є покриття з міді, нікелю, срібла. Внаслідок ушкодження катодного покриття виникає корозійний ГЕ, в якому метал виробу є анодом і руйнується, а метал покриття – катодом, на якому відбувається відновлення кисню або йонів Н+ чи атомів гідрогену у складі води. Отже, катодне покриття захищає метал виробу від корозії у випадку відсутності пор та ушкоджень покриття.
Потенціал анодного покриття менший за потенціал металу виробу. При ушкодженні анодного покриття метал виробу є катодом корозійного ГЕ і тому не руйнується. Прикладом анодного покриття на сталевих виробах є покриття з цинку, хрому тощо.
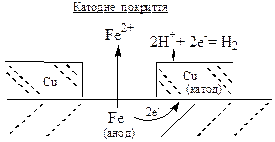
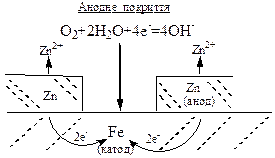
2. Легування металів. Під час легування у склад металів вводять компоненти, які підвищують корозійну стійкість металів. До таких компонентів належать хром, нікель, вольфрам тощо.
3. Зміна складу навколишнього середовища з метою зменшення його агресивності. Наприклад, знекиснення розчинів, яке досягається кип'ятінням розчинів або продуванням через розчини інертних газів, які витісняють з розчинів кисень.
Крім того, з цією метою застосовують інгібітори корозії. Інгібіторами корозії називають речовини, незначні добавки яких до корозійного середовища різко зменшують швидкість корозії металів та сплавів. Дія інгібіторів корозії полягає в тому, що на поверхні металу вони утворюють захисну плівку, яка ізолює метал від навколишнього середовища або так змінює електродний потенціал металу, що його активність зменшується. Як інгібітори корозії використовують деякі неорганічні (хромати, нітрати, фосфати тощо) та органічні (аміни, альдегіди, меркаптани тощо) речовини. Цей спосіб застосовується тільки тоді, коли металічні вироби експлуатуються в обмеженому об'ємі розчинів, наприклад, у парових котлах, у деяких хімічних апаратах, системах охолодження тощо.
4. Електрохімічний захист металів, який поділяють на протекторний та катодний захист.
При протекторному захисті металічну конструкцію сполучають з листами більш активного металу - протектора. Так, якщо до сталевого корпусу судна або до трубопроводу приєднати цинкову пластину, у корозійному ГЕ корпус судна або трубопровід буде виконувати роль катода і тому вони не зазнаватимуть корозійного руйнування. При цьому окиснюється цинкова пластина (протектор), яка виступає у ролі анода, оскільки електродний потенціал цинку менший, ніж потенціал заліза (основного металу сталі).
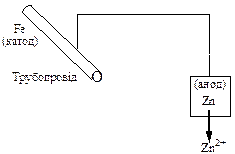
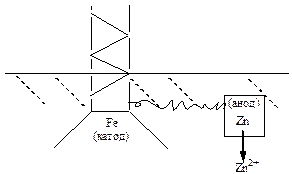
При катодному захисті конструкція або будь-який виріб з металу приєднується до негативного полюса джерела постійного струму. У якості анода використовують куски заліза (рейка, балка, металічний лом) або графітову пластину, які занурюють у розчин або закопують у грунт. На поверхні металічного виробу накопичуються електрони, які утримують катіони металу Men+ на поверхні виробу.
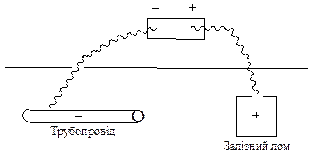
Приклад 1. Складіть схеми корозійних ГЕ, що виникають внаслідок конструкційного контакту нікелю і марганцю: а) у безкисневому водному розчині з рН 5, б) за наявності кисню у розчині з рН 8. Запишіть рівняння електродних процесів та сумарної реакції.
Розв'язання.
Складаємо схеми корозійних ГЕ:
a) Mn | H+, Н2О | Ni,
б) Мn | O2, ОН–, Н2O | Ni
Анодом є марганець, тому що його електродний потенціал (jMn2+/Mn = -1,18 B) менший, ніж електродний потенціал нікелю (jNi2+/Ni = -0,25 B).
Анодний процес в обох корозійних ГЕ однаковий (12.1):
Mn – 2e- = Mn2+
Потенціал анодного процесу, тобто потенціал окиснення атомів мангану, дорівнює електродному потенціалу марганцю.
Рівняння катодного процесу, який відбувається на поверхні нікелю:
а) у безкисневому кислому (рН<7) середовищі (12.2):
2Н+ + 2 е = Н2.
б) у лужному середовищі (рН>7) за наявності кисню (12.5):
O2 + 2Н20 + 4е- = 4ОН-.
Потенціал відновлення йонів гідрогену Н+ розраховуємо за рівнянням Нернста для водневого електрода (10.8):
j H+/H2,Ni = – 0,059рН = – 0,059·5 = – 0,295 В,
а потенціал відновлення кисню – за рівнянням Нернста для кисневого електрода (10.9):
j OH–/O2,Ni = 1,23 - 0,059рН = 1,23 - 0,059·8 = 0,758 В.
Оскільки потенціал окиснення атомів мангану (-1,18 B) менший, ніж потенціал відновлення йонів Н+ (–0,295 В) і потенціал відновлення кисню (0,758 В), то в обох випадках корозія відбувається.
Рівняння сумарних реакцій одержуємо, складаючи рівняння анодного та катодного процесів, а у випадку б) попередньо помноживши рівняння анодного процесу на 2:
а) Mn – 2e- = Mn2+
+ 2Н+ + 2 е = Н2
--------------------------
Mn + 2H+ = Mn2+ + H2,
Продуктом корозії у кислому розчині у відсутності кисню є розчинна у воді сіль мангану.
б) Mn – 2e- = Mn2+ │·2
+ O2 + 2Н20 + 4е- = 4ОН-
------------------------------
2Mn + O2 + 2H2О = 2Mn(OH)2.
У лужному розчині за наявності кисню продуктом корозії є нерозчинний у воді манган (ΙΙ) гідроксид, який утворюється внаслідок взаємодії йонів Mn2+ з йонами ОН–.
Приклад 2. Визначте, чи відбувається корозія олова у безкисневому водному розчині з рН 4.
Розв'язання.
Корозія олова – це процес його окиснення на аноді корозійного ГЕ (12.1):
Sn – 2e- = Sn2+
Потенціал окиснення олова дорівнює потенціалу металічного електрода: jSn2+/Sn = -0,14 B
У кислому розчині (рН<7) у відсутності кисню на катоді корозійного ГЕ має відбуватись відновлення йонів гідрогену (12.2):
2Н+ + 2e- = Н2.
Потенціал цього процесу дорівнює (10.8):
j H+/H2, катод = – 0,059рН = – 0,059·4 = –0,236 В.
Оскільки за умовою перебігу корозії потенціал окиснення металу повинен бути меншим, ніж потенціал відновлення йонів Н+, а в наведеному прикладі електродний потенціал олова (-0,14 В) більший, ніж потенціал водневого електрода (-0,236 В), то робимо висновок: олово за цих умов не кородує.
Приклад 3. Виріб з міді вкритий сріблом. Який з металів кородує внаслідок ушкодження покриття? Складіть схему корозійного ГЕ, що виникає у водному розчині з рН 1 за наявності в електроліті кисню. Запишіть рівняння електродних процесів. До якого типу належить срібне покриття?
Розв'язання.
Складаємо схему корозійного ГЕ, враховуючи що розчин є кислим (рН<7, [H+]>[OH-]):
Cu | O2, H+, Н2O | Ag
Анодом є мідь, тому що її електродний потенціал (jCu2+/Cu = 0,34В) менший, ніж електродний потенціал срібла (jAg+/Ag = 0,80 В). Отже, срібне покриття є катодним.
Рівняння анодного процесу (12.1):
Cu – 2e- = Cu2+ | 2
Рівняння катодного процесу, який відбувається на поверхні срібного покриття:
O2 + 4Н+ + 4е- = 2Н2O. (12.4)
Потенціал катодного процесу дорівнює (10.9):
j OH–/O2,Ag = 1,23 – 0,059рН = 1,23 - 0,059·1 = 1,171 В.
Оскільки потенціал окиснення міді (0,34 В) менший, ніж потенціал відновлення кисню (1,171 В), то корозія відбувається.
Рівняння сумарної реакції одержуємо, складаючи рівняння анодного процесу, помноженого на два, з рівнянням катодного процесу:
2Cu + O2 + 4H+ = 2Cu2+ + 2H2O.
Під час перебігу корозії руйнується метал виробу, тобто мідь. Продуктами корозії є солі купруму.
Приклад 4. Який з металів - магній або мідь - можна використати у якості протектора для захисту сталевої конструкції від корозії? Складіть схему корозійного ГЕ, рівняння електродних процесів та рівняння сумарної реакції, що відбуваються у вологому грунті з рН 9 за відсутності кисню.
Розв'язання.
Оскільки електродний потенціал магнію (jMg2+/Mg = -2,27 B) менший, ніж електродний потенціал основного металу сталі – заліза (jFe2+/Fe = -0,44 В), то саме листи з магнію використовують у якості протектора.
Складаємо схему корозійного ГЕ, враховуючи, що середовище є лужним (рН>7, [OH–]>[H+]):
Mg | OH–, H2O | Fe
Магній, як метал з меншим електродним потенціалом, є анодом, тому окиснюється (12.1): Mg – 2e- = Mg2+
На катоді, тобто на поверхні сталевої конструкції, відбувається процес відновлення атомів гідрогену, що містяться у молекулах води (12.3):
2H+ОН + 2e- = H2 + 2ОН-
Потенціал окиснення магнію (jMg2+/Mg = -2,27 В) менший за потенціал відновлення атомів гідрогену (jH+/H2,Fe = -0,059·9 = -0,531 В). Тому кородують, тобто руйнуються, листи з магнію, а поверхня сталевої конструкції залишається неушкодженою.
Рівняння сумарної реакції:
Mg + 2H+ОН = H2 + Mg(ОН)2
Продуктами корозії є нерозчинний у воді магній гідроксид, який з часом, втрачаючи воду, перетворюється на оксид.
Приклад 5. Складіть схему корозійного ГЕ, який виникає у вологому повітрі під час корозії сталі (атмосферна корозія). Запишіть рівняння електродних та вторинних реакцій.
Розв'язання.
Під час корозії сталі основний метал, тобто залізо, виступає у ролі анода, а включення ферум карбіду Fе3С є катодними ділянками корозійних ГЕ, схема яких наведена нижче:
Fe | O2 , H2O | Fe3C
Рівняння анодного процесу: Fe – 2e- = Fe2+ │·2
Рівняння катодного процесу: O2 + 2Н20 + 4е- = 4ОН–
Рівняння сумарної реакції: 2Fe + O2 + 2Н20 = 2Fe(ОН)2
Рівняння вторинних реакцій:
а) окиснення Fе(OH)2 киснем повітря:
4Fе(OH)2 + O2 + 2Н2O = 4Fe(OH)3,
б) утворення іржі: Fе(OH)3 – Н2O = FeOOH.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3929; Нарушение авторских прав?; Мы поможем в написании вашей работы!