
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Хімічна кінетика 3 страница
|
|
|
|
|
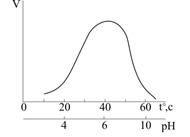
| Рис.3.17. Залежність швидкості V ферментативних реакцій від температури і рН середовища |
Ферменти та їх препарати широко використовують у багатьох галузях народного господарства. За їх допомогою виготовляють продукти молочнокислого бродіння, сири, фруктові соки, різноманітні напої, пиво, медичні препарати, ліки.
Комплекс ферментів прискорює визрівання тіста і значно зменшує витрати цукру на виготовлення хлібо-булочних виробів, підвищує якість м’ясних виробів, ковбас, консервів, напівфабрикатів тощо.
Значний ефект дає згодовування препаратів телятам, поросятам і ягнятам. Ефективним є застосування ферментів для силосування різних кормів, внаслідок чого значно поліпшується біологічна цінність силосованих кормів.
В медицині вивчення ферментативної активності використовують у діагностиці хвороб серця, печінки, жовчних шляхів. У багатьох випадках визначення активності ферменту дає можливість на ранніх стадіях діагностувати інфаркт міокарда.
Запитання для самоконтролю
1. Визначити порядок реакції, що відбувається між розчином окисника, з початковою концентрацією 0,22 моль/л і двовалентним металом, якщо в результаті аналізу були отримані слідуючі результати:
| Концентрація солі металу, моль/л | 0,01 | 0,02 | 0,048 |
| Час реакції, хв. |
Чи є ця реакція дробового порядку?
2. При взаємодії двох речовин, з початковими концентраціями С0 = 1 моль/л, через 16 хв. 40 с. першої речовини залишилося 50 %. Скільки цієї речовини залишиться через 33 хв.20 с., якщо реакція має нульовий, перший, другий, третій порядок?
3. Знайти константи швидкості прямої (k1) і оборотної (k2) реакцій взаємодії двох речовин, якщо кінцева концентрація першої речовини, що більше не змінювалася, була 0,078 моль/л, а її вихідна концентрація в часі складала:
|
|
|
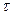 , хв. , хв.
| 71,8 | 145,5 | 215,8 | 264,3 | |
| С, моль/л | 0,366 | 0,277 | 0,215 | 0,174 | 0,152 |
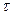 , хв. , хв.
| 333,3 | 383,5 | 478,3 | 506,0 | |
| С, моль/л | 0,130 | 0,121 | 0.106 | 0,100 |
4. Яка кількість Нітрогену та оксиду нітрогену(І) утворюється при розкладанні 4 моль/л оксиду нітрогену(ІІ) при 1273 К, якщо константи швидкості паралельних бімолекулярних реакцій:


дорівнють 25,7 і 18,2 л/моль с?
5. При взаємодії рівних концентрацій речовин [A] = [B] = 0,5 моль/л при температурі 435 К через 60 хвилин знайдено [C] = 0,05 моль/л. При якій температурі кількість речовини С буде в 2 рази більше при тих же умовах, якщо енергія активації реакції другого порядку:

дорівнює 122,42 кДж/моль?
6. Знайти залежність k1 і k2 від температури і значення константи рівноваги при температурі 553 К для реакції:
2АВ L А2 + В2,
якщо при двох різних температурах отримані слідуючі значення констант швидкості реакції:
| Т, К | 666,8 | 698,6 |
| k1 | 0,259 | 1,242 |
| k2, см3 моль-1 с-1 | 15,59 | 67,0 |
7. Визначити енергію активації реакції перетворення речовини в іншу речовину, якщо вона відбувається за першим порядком з слідуючими результатами:
| Т, К | ||||||
| k.105, с-1 | 1,76 | 3,38 | 13,5 | 24,7 | 49,8 | 75,8 |
8. Знайти енергію активації реакції першого порядку, що відбувається при температурі 250 С за 30 хвилин на 30 %, а при температурі 400 С за 5 хв.
9. Розрахувати енергію активації і, користуючись правилом Вант-Гофа ( = 2), визначити час за який прореагує 50 % вихідної речовини при 250 С, якщо при температурі 100 С і вихідних концентраціях першої і другої речовин, які дорівнюють відповідно 0,025 н і 0,0125 н, реакція відбувається за першим порядком, а половина вихідної речовини реагує за 16,8 хвилин.
= 2), визначити час за який прореагує 50 % вихідної речовини при 250 С, якщо при температурі 100 С і вихідних концентраціях першої і другої речовин, які дорівнюють відповідно 0,025 н і 0,0125 н, реакція відбувається за першим порядком, а половина вихідної речовини реагує за 16,8 хвилин.
10. Користуючись графічним методом знайти енергію активації необоротної бімолекулярної реакції, якщо відомі такі експериментальні данні:
| Т, К | 293,1 | 303,1 | 323,2 | |
| K, л.моль-1.хв-1 | 0,713 х 10-2 | 1,5 х 10-2 | 3,5 х 10-2 | 5,98 х 10-2 |
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 296; Нарушение авторских прав?; Мы поможем в написании вашей работы!