
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Захист від корозії
|
|
|
|
Методи захисту металів від корозії дуже різноманітні. Найважливіші з них такі.
1. Застосування хімічно стійких сплавів. Найбільше застосування мають неіржавіючі сталі, до складу яких входить до 18% Cr і до 10% Ni.
2. Захист поверхні металів покриттями. Покриття бувають неметалічні і металічні. До неметалічних відносять покриття лаками, фарбами, емалями, фенолформальдегідними та іншими смолами.
Для металічних покриттів застосовують метали, які утворюють захисні плівки (Cr, Ni, Zn, Cd, Al, Sn та ін.).
Розрізняють анодне і катодне покриття. Якщо потенціал покриття більш від’ємний ніж основного металу, то воно називається анодним, а якщо потенціал покриття більш додатний – катодним. Наприклад, залізо покрите цинком – покриття анодне ( ; залізо покрите оловом – катодне покриття (
; залізо покрите оловом – катодне покриття (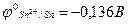 більший за
більший за 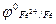 ).
).
Анодне покриття захищає метал, коли воно порушене. Якщо залізо покрите цинком, то при пошкодженні його в присутності вологи утворюється гальванічна пара, в якій цинк виступає анодом і буде руйнуватись:
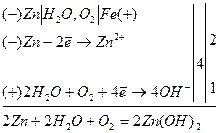
Залізо захищене до того часу, поки не розчиниться весь цинк (рис.39).
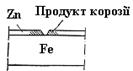
Рис. 39. Схема оцинкованого заліза
При пошкодженні катодного покриття руйнується основний метал. Наприклад, залізо покрите оловом (рис.40). Відбуваються такі процеси:
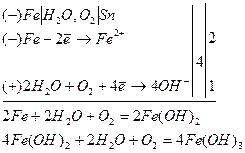
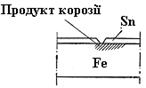
Рис. 40. Схема залужненого заліза
3. Електрохімічні методи:
а) Протекторний захист. Застосовується в тих випадках, коли конструкція (трубопровід, корпус судна) знаходиться в середовищі електроліта (морська вода, грунтові води). Сутність його полягає в тому, що конструкцію з’єднують з протектором-металом, активнішим, ніж метал конструкції. В процесі корозії протектор слугує анодом і руйнується, тим самим захищаючи конструкцію. Як протектори найчастіше використовують магній, алюміній, цинк та їх сплави (рис.41).
|
|
|
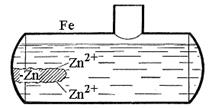
Рис. 41. Принцип протекторного захисту від корозії
б) Катодний захист. Підземну частину металічної конструкції приєднують до від’ємного полюсу джерела струму, і вона стає катодом. Як анод використовують кусок заліза, рельси тощо. Анод руйнується, а на катоді відновлюється окисник (рис.42). Цей метод не може бути застосований в кислих грунтах, де окисником будуть йони Гідрогену. Водень, який буде відновлюватись на катоді, спричиняє крихкість металу.

Рис. 42. Принцип катодного захисту від корозії
4. Застосування інгібіторів і пасиваторів. Інгібітори адсорбуються на поверхні металу і знижують швидкість корозії, а пасиватори реагують з поверхнею металу, утворюючи сольові або оксидні плівки. Як інгібітори застосовують органічні речовини: аміни, аміди, сульфокислоти тощо; як пасиватори – хромати, дихромати, натрій фосфат тощо.
Запитання для самоконтролю
1. Який процес називають електролізом?
2. Додатнім чи від’ємним електродом є анод при електролізі?
3. Який процес – окиснення чи відновлення, відбувається при електролізі на катоді?
4. Чи можна одержати лужні та лужноземельні метали електролізом водних розчинів їх солей?
5. Який необхідно використати анод для покриття одного металу іншим?
6. Які процеси називають гальваностегією, гальванопластикою?
7. В яких галузях промисловості використовують електроліз?
8. Від яких чинників залежить маса речовини, що виділяється при електролізі?
9. Який процес називають корозією?
10. Яка причина термодинамічної можливості корозії?
11. Які відомі типи корозійних руйнувань?
12. Чим відрізняється хімічна корозія від електрохімічної?
13. До якого типу належить атмосферна корозія?
14. Який метал, більш активний чи менш активний, руйнується в процесі корозії?
15. Які йони є окисником при кислотній корозії?
|
|
|
16. Яка речовина є окисником при атмосферній корозії?
17. Які існують методи захисту від корозії?
18. Чим відрізняється катодне покриття від анодного?
19. Які є методи елекрозахисту від корозії?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1318; Нарушение авторских прав?; Мы поможем в написании вашей работы!