
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохімія
|
|
|
|
1. Сформулювати і записати закон Гесса
Тепловий ефект хімічної реакції при сталому об’ємі або тиску не
залежить від шляху процесу, а визначається лише початковим і кінцевим
станами системи (реакція, проводиться в ізобарно-ізотермічних або ізохорно-ізотермічних умовах).
2. Що таке тепловий ефект хімічної реакції?
Тепловий ефект хімічної реакції (DН) – це кількість теплоти, що виділяється або поглинається в ході реакції за умови відсутності будь яких видів корисної роботи, крім роботи розширення, та за умови необоротності реакції.
3. Чому відповідає тепловий ефект хімічної реакції при ізохорному процесі?
DH = DU + pDV
DV = 0;
DH = DU;
Отже, при ізохорному процесі тепловий ефект реакції дорівнює зміні внутрішньої енергії
4. Чому відповідає тепловий ефект хімічної реакції при ізобарному процесі?
Qр = DU + РDV,
звідки
Qр = (U2 – U1) + Р(V2 – V1) = (U2 + РV2) – (U1 + РV1);
прийнявши, що
U + РV = Н,
матимемо:
QР = Н2 – Н1 = DН
Отже, при ізобарному процесі тепловий ефект реакції дорівнює зміні ентальпії системи DН.
5. Що таке теплота утворення?
Теплота утворення – це тепловий ефект хімічної реакції утворення 1 моль складної речовини із простих.
6. Що таке теплота згорання?
Теплота згорання – це тепловий ефект хімічної реакції повного окиснення 1 моль речовини в атмосфері чистого повітря (або в надлишку О2) з утворенням продуктів окиснення.
7. Що таке стандартна теплота утворення та згорання?
стандартна теплота утворення та згорання – це теплові ефекти хімічної реакції, що проходять за стандартних умов: Т = 298 К; р = 101,3 кПа або 1 ат, або 760 мм. Рт. Ст.
8. Записати і сформулювати 1-й та 2-й наслідок із закону Гесса.
Перший наслідок із закону Гесса: тепловий ефект реакції DH дорівнює
|
|
|
різниці між сумами теплот (ентальпій) утворення продуктів реакції та теплот
(ентальпій) утворення вихідних речовин (в розрахунках використовують
ентальпії, що помножені на відповідні стехіометричні коефіцієнти):
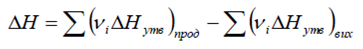
Другий наслідок із закону Гесса: Тепловий ефект хімічної реакції дорівнює
різниці сум теплот згорання вихідних речовин і продуктів реакції (при
врахуванні відповідних стехіометричних коефіцієнтів вихідних рчовин і
продуктів):
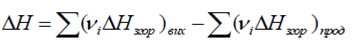
9. Вміти одержувати рівняння Кірхгофа.
DH = n DH продукт – n DH реаг
DH/T = iS(ni DH продукт)/T – iS(ni DH реаг)/T = DCp;
DH/T = Cp;
dH = DCpdT;
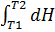 =
= 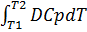 ;
;
DHт2 – DHт1 = 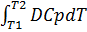 ;
;
DHт2 = DHт1 + 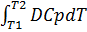 ;
;
10. Що описує рівняння Кірхгофа?
Рівняння Кірхгофа дає змогу розрахувати тепловий ефект хім реак при будь якій температурі, якщо у вас є тепловий ефект хім. Реак при іншій температурі і залежність теплоємностей від Т у цьому інтервалі температур
11. Вміти записати рівняння Кірхгофа за умови сталості різниці теплоємностей
D 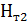 = D
= D  +
+ 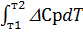
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 214; Нарушение авторских прав?; Мы поможем в написании вашей работы!