
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна рівновага. Характеристичні функції та напрям процесів
|
|
|
|
Характеристичні функції та напрям процесів
1. Записати вираз І і ІІ об’єднаного закону термодинаміки
dU = TdS – pdV;
2. Що таке вільна енергія Гельмгольца та Гіббса?
Ві́льна ене́ргія Гельмго́льца — термодинамічний потенціал, який визначає рівноважні термодинамічні характеристики системи в залежності від об'єму та температури.
dF = - SdT - PdV
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
G=U+PV-TS
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
3. Записати функціями яких параметрів є функції F і G.
F є функцією параметрів V; T
G є функцією параметрів T; p
4. Чому вільні енергії називаються вільними???????
Тому, що вільна енергія може бути використана повність на виконання роботи.
5. Знати зв’язок між характеристичними функціями і термодинамічними параметрами.
dH = TdS + Vdp;
dF = - SdT – pdV;
dG = - SdT + Vdp
dU = TdS – pdV
dS = dQ/T
6. Сформулювати ІІ закон термодинаміки для ізольованих систем, використовуючи поняття ентропії.
В ізольованих системах самочинно відбувається процес зі збільшенням ентропії.
7. Записати умови самочинного перебігу процесів, використовуючи вільні енергії.
DF < 0; DG < 0.
8. Знати умови рівноваги (S, F, G).
DS = 0; DF = 0; DG = 0;
9. Які процеси є термодинамічно забороненими? – частково зроблено.
DG > 0; DF > 0;
1. Записати формулу і дати визначення хімічного потенціалу компоненту.
Хими́ческий потенциа́л dm — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергию добавления одной частицы в систему без совершения работы.
|
|
|
Для систем, состоящих из одного компонента, можно доказать, что химический потенциал задаётся формулой
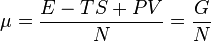
N — количество частиц в системе. G — потенциал Гиббса. Е — энергия системы
2. Вміти записати константу рівноваги для довільної реакції.
aA + bB = cC + dD – хімічна реакція
K = 
3. Вивести рівняння ізотерми хімічної реакції


m i = m i 0 + RT In p i ,

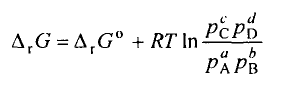 рівняння ізотерми хімічної реакції
рівняння ізотерми хімічної реакції
4. Вміти виводити константи рівноваги через мольну частку та через молярну концентрацію.
аА + bB = mM + nN

Кр =
 P (i) =
P (i) = 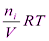 = С i RT,
= С i RT,
Кр =
або

Кр =

Кс =
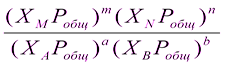
Кр =
або
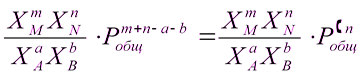
Кр =
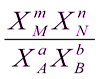
Кх =
5. Знати як залежить константа рівноваги від температури. Рівняння ізобари та ізохори хімічної реакції в диференційні та інтегральній формі.

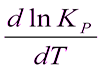 =
= 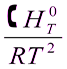
 |
 =
= 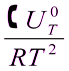
6. Принцип Ле-Шательє
Якщо на систему, яка знаходиться в стійкій рівновазі, подіяти ззовні, то в системі будуть відбуватися ті процеси, що направлені на компенсацію зовнішнього впливу.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 321; Нарушение авторских прав?; Мы поможем в написании вашей работы!