
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Завдання для самостійного виконання
|
|
|
|
1.1. Запишіть символи наступних хімічних елементів: Алюміній, Аргентум, Аурум, Барій, Бор, Бром, Гідроген, Йод, Калій, Кальцій, Карбон, Купрум, Магній, Манган, Меркурій, Натрій, Оксиген, Плюмбум, Сульфур, Ферум, рбі, Фосфор, Хлор, Цинк. Знайдіть кожен з них в періодичній таблиці Д.І.Менделєєва. Для кожного вкажіть порядковий номер, групу, підгрупу, період, відносну атомну масу. Які ще характеристики даних елементів ви можете зазначити, користуючись таблицею Менделєєва?
1.2. Запишіть формули наступних сполук: ферум (ІІІ) хлорид, натрій оксид, алюміній сульфід, фосфор (ІІІ) оксид та фосфор (V) оксид. Знайдіть в записах коефіцієнти. Що таке хімічна формула та індекс? Як записати вислови: „п’ять молекул кисню”, „три молекули води”, „сім атомів Оксигену” за допомогою символів і цифр? Що таке коефіцієнт?
1.3. Запишіть формули оксидів Нітрогену, знаючи, що його валентність змінюється від 1 до 5 і він менш електронегативний елемент, ніж Оксиген. Назвіть сполуки.
1.4. Визначте відносну молекулярну масу сульфатної кислоти та хром (ІІІ) сульфату.
Аналогічні завдання – дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 1 – 15.
1.5. Визначити масову частку нітрогену у молекулі амоній нітрату NH4NO3.
Аналогічні завдання – дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 16 – 30.
1.6. Скласти електронні формули та електронно-графічні схеми будови атома хімічних елементів №№ 6, 12, 16, 20, 22, 30.
1.7. Для елементів 1) 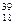 Е, 2)
Е, 2) 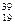 Е, 3)
Е, 3)  Е, 4)
Е, 4)  Е вкажіть:
Е вкажіть:
а) назву, б) число протонів і нейтронів в ядрі його атома, в) число електронів у атомі.
1.8. Електронна формула атома хімічного елемента має закінчення
а)...3p3, б) …3d3 4s2, в)...3s2. Напишіть повну електронну формулу цих елементів, вкажіть порядковий номер і назву кожного елемента.
|
|
|
1.9. Розв’язати задачі:
1) Масова частка гідрогену у леткій водневій сполуці ІV – валентного елемента становить 25%. Який це елемент?
2) Густина за воднем вищого оксиду VІ – валентного елемента становить 40. Масова частка Оксигену в молекулі даного оксиду складає 60%. Який це елемент?
3) Окиснилася проста речовина, утворена двовалентним металом, масою 4 г. Внаслідок цього утворився оксид масою 5,6 г. Назвіть елемент.
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 208 – 240.
1.10. За планом охарактеризуйте елементи №6, №11.
1.11. Напишіть рівняння реакцій, що відбуваються при таких перетвореннях:
а) натрій → натрій гідроксид → натрій сульфат → барій сульфат;
б) калій оксид → калій гідроксид → калій хлорид → аргентум хлорид;
в) фосфор → фосфор (V) оксид → натрій ортофосфат → барій ортофосфат;
г) карбон → карбон (ІV) оксид → карбонатна кислота → натрій карбонат;
д) магній →магній оксид → магній хлорид → магній гідроксид → магній сульфат →барій сульфат.
1.12. Розв’яжіть задачі:
1) Визначте метал, якщо 9 г його гідроксиду при розкладанні утворює 7,2 г метал (ІІ) оксиду.
2) При взаємодії 4 г двовалентного металу з бромом добуто 20 г броміду. Визначте метал.
3) При згоранні 0,24 г простої речовини, утвореної атомами чотиривалентного елемента, добули 0,448 л газу (н.у.). Визначте елемент.
4) У результаті відновлення воднем 18,2 г оксиду п’ятивалентного металу утворилось 0,5 моль води. Назвіть метал.
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 208 – 240.
1.13. За молекулярними формулами речовин написати електронні формули атомів елементів, що їх утворюють, показати утворення хімічного зв’язку, положення спільних електронних пар та назвати тип хімічного зв’язку:
|
|
|
Cl2, NH3, KH, ZnS, HBr, H2S, CS2, H2SO4, H3PO4.
1.14. За назвами речовин скласти формули:
купрум (ІІ) оксид, літій сульфід, вода, водень, аміак, кисень, калій хлорид, карбон (ІV) оксид, хлор, гідроген хлорид, бром, натрій бромід.
Встановити тип хімічного зв’язку та записати формули речовин у відповідні графи таблиці:
| ковалентний | йонний | |
| неполярний | полярний | |
1.15. Побудувати електронні формули атомів та йонів Алюмінію, Сульфуру, Цинку, Флуору. Показати валентні електрони і зміни в будові зовнішнього енергетичного рівня за допомогою електронно-графічних схем.
1.16. Розмістити речовини у порядку зростання полярності зв’язку:
а) натрій хлорид, хлор, хлор (ІІ) оксид, фосфор (V) оксид;
б) вольфрам (VІ) оксид, телур (VІ) оксид, молібден (VІ) оксид, селен (VІ) оксид, хром (VІ) оксид, сульфур (VІ) оксид.
1.17. Скласти схеми будови трьох йонів елементів третього періоду, подібних за будовою до атома Аргону.
1.18. Розв’яжіть задачі:
1) Алюміній кількістю речовини 0,5 моль повністю прореагував з сульфатною кислотою. Яка кількість речовини газу виділилась?
2) Цинк кількістю речовини 0,2 моль повністю прореагував з натрій гідроксидом. Яка кількість речовини та об’єм газу виділились?
3) 0,4 моль алюмінію повністю прореагували з калій гідроксидом. Яка маса утвореної солі? Який об’єм газу виділився?
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92 – 106.
1.19. Напишіть формули речовин за назвами: магній хлорид, ортофосфатна кислота, амоній гідроксид, гідроген фтори, барій гідроксид, меркурій (ІІ) гідроксид, нітратна кислота, калій гідроксид, алюміній хлорид, стронцій гідроксид, гідроген бромід, калій ортофосфат.
Запишіть рівняння реакцій дисоціації для вказаних речовин. Для багатоосновних кислот та багатокислотних основ записати ступеневі та сумарні рівняння реакцій дисоціації.
1.20. Складіть формули солей за назвами і запишіть сумарні рівняння реакції дисоціації для кожної солі: кальцій нітрат, алюміній сульфат, купрум хлорид, ферум (ІІІ) сульфат, натрій карбонат, стронцій хлорид, алюміній нітрат.
1.21. Розв’яжіть задачі:
1) На купрум (ІІ) оксид кількістю речовини 0,4 моль подіяли сульфатною кислотою до його повного розчинення. Яка маса солі утворилась? Назвіть сіль.
|
|
|
2) Кальцій гідроксид кількістю речовини 3 моль нейтралізували хлоридною кислотою. Яка маса і кількість речовини солі утворилась? Назвіть сіль.
3) На розчин алюміній гідроксиду подіяли розчином їдкого натру до утворення 2 моль натрій дигідроалюмінату. Яка кількість речивини вихідних сполук вступила у реакцію?
4) На суміш порошків магнію та міді подіяли розчином сульфатної кислоти. Внаслідок реакції виділився газ об’ємом 3,36 л. Обчисліть масовий склад суміші.
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92-106, 147-160, 174-193, 494-50.0
1.22. Закінчити подані схеми реакцій, визначити тип кожної з них:
а) FeCl3 + … → Fe(OH)3 + …
б) Fe + … →FeCl2 + …
в) Al(OH)3 → Al2O3 + …
г) CaO + CO2 = …
1.23. Термохімічні рівняння записати так, як прийнято в термодинаміці.
а) 2Cu + O2 = 2CuO + 276 кДж,
б) CaCO3 = CaO + CO2 – 180 кДж
Обчислити за рівняннями:
а) кількість теплоти, яка виділилася при окисненні 6,4 кг міді:
б) кількість теплоти, що ввібралася при утворенні 1 т негашеного вапна.
1.24. При згоранні в кисні магнію масою 3 г виділилася теплота кількістю 75 кДж. Написати термохімічне рівняння реакції, зазначити тип термічного процесу.
1.25. Розв’яжіть задачу:
Температурний коефіцієнт реакції складає 3. Як зміниться швидкість реакції, якщо підвищити температуру на 50°?
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 400 -410.
1.26. В замкнутій системі реакція гідроген хлориду з киснем оборотна.
4HCl (г.) + O2 (г.) = 2Cl2 (г.) + 2H2O (г.), ΔH = -116,4
Як впливатимуть на рівновагу системи наступні зміни: а) підвищення тиску; б) підвищення температури; в) введення каталізатора?
1.27. Як зміниться швидкість хімічної реакції окиснення нітроген (ІІ) оксиду до нітроген (IV) оксиду киснем, якщо реакція проходить у закритому об’ємі, при збільшення тиску у 4 рази?
1.28. В реакції синтезу аміаку в стані рівноваги концентрації реагуючих речовин становлять: С(азоту) = 0,01 моль/л, С(водню) = 2 моль/л, С(аміаку) = 0,4 моль/л. Обчисліть константу рівноваги та вихідні концентрації азоту і водню.
|
|
|
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 400 -418.
1.29. Напишіть молекулярні, йонно-молекулярні та йонні рівняння реакцій між парами речовин:
а) натрій карбонат та нітратна кислота; б) купрум (ІІ) хлорид та натрій гідроксид; в) калій гідроксид та сульфатна кислота; г) натрій силікат та хлоридна кислота.
1.30. На основі йонних запишіть молекулярні і йонно-молекулярні рівняння реакцій:
а) Pb2+ + S2- = PbS. б) H + + OH- = H2O.
в) CaCO3 + 2H+ = Ca2+ + CO2 + H2O. г) 2H+ + SiO32- = H2SiO3.
д) 2H+ + CO3 2- = CO2 + H2O. е) Al3+ + 3OH- = Al(OH)3.
1.31. Які з наведених пар речовин не можуть одночасно перебувати у водному розчині: а) хлоридна кислота та натрій гідроксид; б) натрій гідрокарбонат та нітратна кислота; в) купрум (ІІ) хлорид та калій гідроксид; г) калій хлорид та натрій нітрат; д) калій силікат та натрій гідроксид; е) натрій сульфат та барій хлорид? Доведіть це відповідними рівняннями реакцій.
1.32. Розв’яжіть задачі:
1) У воді масою 160 г розчинили купрум (ІІ) сульфат масою 40 г. Яка масова частка солі в розчині?
2) До розчину магній сульфату масою 300 г з масовою часткою солі 15% долили 200 мл дистильованої води. Яка масова частка солі в новоутвореному розчині?
3) Яка маса калій гідроксиду міститься в розчині об’ємом 600 мл з масовою часткою речовини 20%, якщо густина даного розчину 1,1 г/мл?
4) Визначити масову частку хлоридної кислоти в розчині, добутому розчиненням за нормальних умов 33,6 л газоподібного гідрогенхлориду у 245,25 г води.
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 267 – 283.
1.33. Визначити ступінь окиснення елементів у сполуках:
N2, N2O, NO, N2O3, NO2, N2O5, HNO3, Ca(NO3)2, Cl2, HCl, NaCl, BaO, HClO, Ca3N2, Fe2O3, KOH, CrO3, Cr2O3, CrO, HPO3, H3PO4, Ca3(PO4)2, NaHSO4, Al2(SO4)3, Ba(NO3)2, Fe(OH)3, NH4NO3, NH4H2PO4, (NH4)3PO4, KAl(SO4)2.
1.34. Показати перехід електронів, що відбувається згідно зі схемами, встановити, окисником чи відновником виступає в даній реакції елемент, і який процес – окиснення чи відновлення – при цьому відбувається:
a) Mg+2 … → Mg0; б) Fe0 … → Fe+3; в) H2SO4 … → S0; г) NH3 … → N20; д) MnO4- … → MnO4-2; е) NO3- … → N2O; є) Fe+2 … → Fe+3; ж) S-2 … → S+6.
1.35. Методом електронного балансу урівняти рівняння окисно-відновних реакцій, встановити окисник та відновник і процеси, що при цьому відбуваються (окиснення чи відновлення):
K + S = K2S, Zn + HCl = ZnCl2 + H2,
HJ + H2SO4 = J2 + H2S + H2O, Pb(NO3)2 = PbO + NO2 + O2,
NH3 + O2 = NO + H2O, Fe3O4 + Al = Fe + Al2O3,
NaJ + NaJO3 + H2SO4 = J2 + Na2SO4 + H2O.
1.36. Розв’яжіть задачі:
1) При спалюванні зразка сталі масою 60 г виділилось 2,24 л карбон (IV) оксиду. Визначити масову частку карбону у цьому зразку сталі.
2) Обчислити масу хрому, який можна добути шляхом алюмотермії з 8 кг хром (ІІ) оксиду, масова частка домішок в якому 5%.
3) На 10 г суміші міді та алюмінію подіяли розведеною сульфатною кислотою, при чому виділилось 5,6 л газу (н.у.). Визначити масові частки металів у вихідній суміші.
4) Водний розчин натрій хлориду масою 200 г з масовою часткою солі 11,7% піддали електролізу. Обчислити масову частку лугу в розчині по закінченні електролізу.
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92 – 106, 194 – 207.
Розв’яжіть задачі:
1.37. Яку масу амоній хлориду NH4Cl можна добути з хлороводню масою 73 г та амоніаку, якщо вихід продукту по відношенню до теоретично можливого становить 95%?
1.38. Який об’єм амоніаку можна добути при взаємодії 44,8 л азоту з воднем (н.у.), якщо вихід продукту реакції становить 90% по відношенню до теоретично можливого?
1.39. Силіцій (IV) оксид відновили вуглецем, в результаті чого утворилось 11,2л чадного газу СО (н.у.). Обчисліть масу силіцій (IV) оксиду, який вступив у реакцію, якщо вихід чадного газу становить 80% по відношенню до теоретично можливого.
1.40. Який об’єм амоніаку утвориться при взаємодії азоту об’ємом 12, 4 л, у якому 10% домішок, з воднем, якщо вихід продукту реакції становить 96% по відношенню до теоретично можливого?
1.41. Спалили фосфор масою 31 г. Утворену речовину розчинили у воді, при чому утворилось 90 г ортофосфатної кислоти. Яка масова частка виходу кислоти по відношенню до теоретично можливого?
1.42. Яку масу натрій силікату можна добути при сплавлянні 50 г силіцій (IV) оксиду, у якому 10% домішок, і 120 г кристалічного натрій гідроксиду?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 419 – 450.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2672; Нарушение авторских прав?; Мы поможем в написании вашей работы!