
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неметалічні елементи та їх сполуки
|
|
|
|
ЗАВДАННЯ ДЛЯ САМОСТІЙНОГО ВИКОНАННЯ
2.1. Розставте коефіцієнти методом електронного балансу:
а) NaOH + Cl2 → NaCl + NaClO3 + H2O,
б) H2S + Br2 + H2O → HBr + H2SO4,
в) MnO2 + HCl → Cl2 + MnCl2 + H2O,
г) KClO3 + S → SO2 + KCl,
д) Cl2 + Br2 + KOH → KCl + KBrO + H2O,
е) KMnO4 + HCl → Cl2 + KCl + MnCl2 + H2O.
2.2. Складіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
а) KBr → Br → NaBr → NaCl → HCl,
б) KClO3 → O2 → ZnO →ZnCl2 → NaCl.
2.3. Розв’яжіть задачі:
а) Визначити об’єм хлору (н.у.), який утвориться при взаємодії 15,8 г калій перманганату з концентрованою хлоридною кислотою, якщо вихід хлору складає 85%.
б) При термічному розкладі 2,45 г бертолетової солі KClO3 виділилося 0,56 л кисню (н.у.). Визначте масову частку домішок у солі.
в) Скільки грамів хлоридної кислоти з масовою часткою хлороводню 10% необхідно для розчинення вапняку масою 3,68 г?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 419 – 450.
2.4. Складіть рівняння реакцій, що відбуваються за схемою:
а) H2S → S → SO2 → NaHSO3 → Na2SO3 → BaSO3.
б) Mg → MgS → H2S→ ZnS → SO2.
/ \
S → SO2 → SO3.
2.5. Урівняйте рівняння МЕБ, визначте окисник та відновник:
S + HNO3 (розв.) → H2SO4 + NO, S + HNO3 (конц.) → SO2 + NO2 + H2O,
S + HNO3 (конц.) → H2SO4 + NO2 + H2O, S + H2SO4 (конц.) → SO2 + H2O.
2.6. Розв’яжіть задачі:
а) Яку масу алюміній сульфіду можна добути з 5,4 г алюмінію та 71 г сірки, в якій 10% домішок?
б) Який об'єм сульфур (IV) оксиду утвориться, якщо в реакцію вступлять 3,56 г сірки, у якій 10% домішок, та 2,24 л кисню (н.у.)?
в) Розрахувати масу калій перманганату, який потрібно розкласти при нагріванні, щоб добути 3,36 л кисню (н.у.), якщо вихід продукту складає 80%.
г) Обчислити масу калій хлорату (бертолетова сіль), який потрібно розкласти в присутності каталізатора, щоб добути 5,6 л кисню (н.у.), якщо у солі 15% домішок.
|
|
|
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92 – 106, 124 – 128.
2.7. Напишіть рівняння реакцій сульфатної кислоти з алюміній оксидом, барій гідроксидом, натрій сульфідом в молекулярній, йонно-молекулярній та йонній формі.
2.8. Напишіть рівняння реакції взаємодії цинку з розчином сульфатної кислоти, поясніть окиснювальні властивості розведеної сульфатної кислоти. Атоми якого хімічного елемента виступають в ролі окисника?
2.9. Напишіть рівняння реакції розчину сульфатної кислоти та розчину барій нітрату в йонній, йонно-молекулярній та йонній формі.
2.10. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
S0 → S-2 → S+4 → S+6 → SO 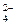 .
.
2.11. Розв’яжіть задачі:
а) Обчислити масу осаду, утвореного в результаті зливання 200 г розчину з масовою часткою барій гідроксиду 8% та 4оо г розчину з масовою часткою сульфатної кислоти 1%.
б) Який об’єм розчину з масовою часткою сульфатної кислоти 20%, густиною 1,14 г/см3, і яку кількість речовини цинку треба взяти, щоб добути водень, необхідний для відновлення 20,88 г залізної окалини?
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92 – 106, 124 – 128, 147-160, 174-207, 267-283.
2.12. Обчислити густину за повітрям і воднем сульфур (IV) оксиду.
2.13. Написати рівняння реакцій, за допомогою яких можна здійснити перетворення:
а) S → FeS → H2S → S → H2S → SO2 → NaHSO3.
б) ZnS → SO2 → SO3 → H2SO4 → BaSO4.
Останнє рівняння написати в молекулярній, йонно – молекулярній та йонній формі.
2.14. Розв’яжіть задачі:
а) Який об'єм сульфур (IV) оксиду можна добути при спалюванні гідроген сульфіду (H2S) об'ємом 6,16 м3, у якому 10% домішок, за нормальних умов?
б) Знайти масу осаду, який утвориться при зливанні 100 г розчину купрум (ІІ) сульфату з масовою часткою солі 16% та 200 г розчину барій хлориду з масовою часткою солі 10%.
|
|
|
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 419 – 450.
2.15. Для запропонованих пар речовин написати продукти реакцій, урівняти МЕБ, вказати окисник та відновник:
Ca + N2 →; Zn + P →; Li + N2 →;
P + O2 →; P + Cl2 →; P + Br2 →.
2.16. Розв’яжіть задачі:
а) Оксид п’ятивалентного елементу містить 34,8% Оксигену. Який це елемент?
б) Спалили фосфор масою 31 г. Утворену речовину розчинили у воді, внаслідок чого утворилась ортофосфатна кислота масою 90 г. Визначте вихід продукту за відношенням до теоретично можливого.
в) Суміш водню з азотом, що містила азот об'ємом 67,2 л (н.у.), пропустили над нагрітим каталізатором. Утворився аміак об'ємом 112 л. Яка об’ємна частка виходу продукту за відношенням до теоретичного?
г) Фосфор масою 13,8 г з масовою часткою домішок 0,1 спалили в кисні об'ємом 14 л (н.у.). Утворений оксид розчинили у воді. Яка маса ортофосфатної кислоти утворилась при цьому?
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 208 – 240, 419 – 450.
2.17. Складіть рівняння реакції взаємодії ферум (ІІ) сульфіду і хлоридної кислоти. Чому гідрогенсульфід (сірководень) добувають взаємодією ферум (ІІ) сульфіду з хлоридною кислотою, а не з нітратною?
2.18. Як добути нітратну кислоту в лабораторії? Напишіть рівняння реакції.
2.19. Нітратну кислоту використовують для визначення домішок в золотих виробах. Поясніть, чим зумовлюється поява бурого газу та блакитного розчину від дії на такі вироби розчину нітратної кислоти. Складіть рівняння реакції.
2.20. Складіть рівняння реакції термічного розкладу нітратів амонію, натрію та цинку.
2.21. Як здійснити такі перетворення:
а) калій карбонат → калій нітрат → нітратна кислота → нітроген (ІІ) оксид → нітроген (ІV) оксид,
б) азот → нітроген (ІІ) оксид → нітроген (ІУ) оксид → нітратна кислота → амоній нітрат?
Складіть рівняння реакцій, зазначте умови їх перебігу.
2.22. Розв’яжіть задачу:
Яку масу нітратної кислоти можна добути з калій нітрату масою 20,2 г при дії на нього надлишком сульфатної кислоти, якщо вихід продукту за масою складає 0,98 від теоретично можливого?
|
|
|
Аналогічні завдання - дивись збірник ”600 задач”; Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 439 - 450.
2.23. Напишіть рівняння реакцій ортофосфатної кислоти з калій оксидом, магнієм, аргенум нітратом, натрій гідроксидом, аміаком. Де це можливо, запишіть йонно-молекулярні та йонні рівняння реакцій.
2.24. Напишіть рівняння реакцій взаємодії дуже розбавленої нітратної кислоти (в надлишку) з кальцієм, цинком, магнієм та алюмінієм, якщо в цих реакціях Нітроген відновлюється відповідно до ступеня окиснення +1, 0, -3 і -3. Складіть електронний баланс, встановіть окисника та відновника.
2.25. Розв’яжіть задачі:
а) Кальцій нітрат масою 16,4 г повністю розклали. Виділився газ об'ємом 1,68 л. Який це газ? Який його вихід (за об'ємом) по відношенню до теоретично можливого?
б) Технічний аргентум нітрат масою 35,42 г з масовою часткою домішок 4% повністю розклали. Назвіть всі продукти реакції. Обчисліть об’єми кожного з утворених газів.
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 419 – 450.
2.26. Напишіть чотири рівняння хімічних реакцій, в результаті яких утворюється амоніак.
2. 27. При пропусканні амоніаку через трубку з розжареним купрум (ІІ) оксидом утворюється металічна мідь. Напишіть рівняння цієї реакції, вкажіть окисник та відновник, покажіть перехід електронів.
2.28. Складіть рівняння реакцій, в результаті яких утворюється: а) дигідроортофосфат амонію; б) гідроортофосфат амонію; в) ортофосфат амонію.
2.29. Гідрокарбонат амонію іноді використовують при випіканні кондитерських виробів. Які властивості гідрокарбонату амонію при цьому використовуються? Напишіть рівняння відповідної реакції.
2.30. Запишіть рівняння реакцій за схемами:
а) азот ® амоніак ® амоній гідроксид ® амоній нітрат;
б) амоній гідроксид ® амоній хлорид ® амоніак;
в) амоніак ® амоній гідроксид ® амоній ортофосфат.
2.31. Розв’яжіть задачу: При взаємодії амоніаку об’ємом 33,6 л (н.у.) з ортофосфатною кислотою утворився амоній ортофосфат масою 55 г. Визначити масову частку виходу продукту реакції по відношенню до теоретично можливого.
|
|
|
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 439 – 450.
2.32. Напишіть рівняння реакцій:
а) термічного розкладу амоній нітрату; б) амоній сульфату і нітратної кислоти; в) амоній хлориду і аргентум нітрату; г) амоній сульфату та хлоридної кислоти; д) амоній сульфіду та плюмбум нітрату; е) термічного розкладу амоній карбонату.
2.33. Розв’яжіть задачі:
а) Амоній карбонат масою 21,33 г розклали при нагріванні. Обчисліть об’єми газів, що утворились.
б) При пропусканні амоніаку через концентровану хлоридну кислоту утворилась сіль масою 21,4 г. Який об'єм амоніаку прореагував?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 92 – 106, 147 – 160, 174 – 193.
в) Який об'єм амоніаку можна добути нагріванням суміші, що містить амоній хлорид масою 5,35 г і кальцій гідроксид масою 7,4 г?
г) Газ, що утворився внаслідок горіння амоніаку кількістю речовини 0,2 моль, повністю прореагував з літієм з утворенням нітриду масою 6 г. Який вихід продукту за відношенням до теоретично можливого?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 419 – 450.
2.34. Написати рівняння реакцій між наступними речовинами в молекулярній, йонно – молекулярній та йонній формі:
а) кальцій оксид + ортофосфатна кислота; б) кальцій гідроксид + ортофосфатна кислота;
в) натрій ортофосфат + барій нітрат; г) натрій ортофосфат + аргентум нітрат;
д) кальцій ортофосфат + ортофосфатна кислота.
2.35. Написати рівняння реакцій, які необхідні для здійснення наступних перетворень:
N2 ↔ NH3 → NO
↓
NH4Cl → NH3.
2.36. Розв’яжіть задачі:
а) При дії на суміш натрій хлориду, натрій карбонату та натрій нітрату масою 50 г хлоридної кислоти виділяється 2,24 л (н.у.) вуглекислого газу, а при прожарюванні такої самої маси суміші виділяється 2,24 л (н.у.) кисню. Визначте масовий склад суміші.
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 494 – 500.
б) Яку масу розчину ортофосфатної кислоти можна добути з 500 кг фосфориту, у якому масова частка кальцій ортофосфату складає 0,75, якщо вихід продукту становить 96%, а масова частка кислоти в розчині 25%?
в) Яка сіль та якої маси утвориться при зливанні 200 мл розчину з масовою часткою кальцій гідроксиду 0,2 моль/л та 200 г розчину з масовою часткою ортофосфатної кислоти 9,8%?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 267-276, 352-364, 439-450.
2.37. Які з зазначених речовин можна використати для осушення вуглекислого газу: фосфор (V) оксид, вапняна вода, баритова вода, розчин сульфатної кислоти, розчин натрій гідроксиду. Для речовин, які неможливо використати, напишіть відповідні рівняння реакцій.
2.38. Карбонати лужних металів, а також амонію та талію розчинні у воді і їх розчини мають лужну реакцію. Поясніть причину. Напишіть рівняння відповідних реакцій.
2.39. Напишіть рівняння реакцій за схемою:
а) барій карбонат → барій хлорид → барій нітрат → барій сульфат,
б) вуглець → карбон (ІІ) оксид → карбон (ІV) оксид → кальцій карбонат ↔ кальцій гідрокарбонат → кальцій карбонат;
в) кремній → силіцій (IV) оксид → натрій силікат → силікатна кислота → силіцій (IV) оксид.
2.40. Розв’яжіть задачі:
а) Визначити об’єм вуглекислого газу та масу негашеного вапна, які можна добути при випалюванні 500 кг вапняку, що містить 8% некарбонатних домішок.
б) Яка речовина і якої маси утвориться при пропусканні продукту повного згоряння 8,96 л (н.у.) гідрогенсульфіду через 129,5 мл розчину натрій гідроксиду з масовою часткою розчиненої речовини 11% і густиною розчину 1,11 г/см3?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 194-207, 277-283, 351-364, 432-438.
2.41. Скласти рівняння реакцій за схемами:
а) калій силікат + хлоридна кислота; б) барій хлорид + натрій карбонат; в) натрій ортофосфат + аргентум нітрат; г) кремнезем (пісок, силіцій (IV) оксид) + калій гідроксид; д) аргентум нітрат + калій карбонат; е) натрій гідроксид + харчова сода (натрій гідрокарбонат); є) кремнезем + сода (натрій карбонат); ж) кальцій + силіцій; з) кремнезем + фторидна кислота; и) фтор + силіцій; і) кальцій карбонат + кремнезем.
2.42. Написати рівняння реакцій, за допомогою яких можна здійснити наступні перетворення:
BaCl2 → BaCO3 → Ba(HCO3)2 → BaCO3 → CO2 → K2CO3.
2.43. Розв’яжіть задачі:
а) Який об’єм вуглекислого газу утвориться внаслідок термічного розкладу 3 моль калій гідрокарбонату, масова частка домішок в якому становить 3%?
б) Розчин натрій гідроксиду масою 31,25 г з масовою часткою речовини 8% поглинув 700 мл (н.у.) карбон (IV) оксиду. Яка сіль і якої маси при цьому утворилась?
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 194-207, 277-283, 351-364, 432-438.
2.44. Запишіть рівняння реакцій за схемами:
а) барій карбонат + вуглекислий газ + вода;
б) натрій силікат + алюміній хлорид;
в) калій гідрокарбонат + сульфатна кислота;
г) калій силікат + магній хлорид.
2.45. Запропонуйте реакції для встановлення якісного складу кухонної солі, харчової соди, аміачної селітри, мідного купоросу.
2.46. Як можна розпізнати йони в суміші йонів?
2.47. Запропонуйте план досліду для виявлення якісного складу бордоської суміші (інсектицид, що застосовується в сільському господарстві).
2.48. Розв’яжіть задачі:
а) Калій карбонат масою 8,12 кг з масовою часткою домішок 15% сплавили з піском масою 3,5 кг, в якому масова частка силіцій (IV) оксиду становила 85,7%. Яка маса калій силікату утворилася?
б) На суміш карбонату і гідроген карбонату натрію масою 3,8 г подіяли надлишком хлоридної кислоти. Внаслідок реакції виділився газ об’ємом 0,896 л. Визначте масові частки солей у вихідній суміші.
Аналогічні завдання - дивись збірник ”600 задач”;Кукса С.П.; Тернопіль, „Мандрівець”, 2000 рік, вправи 194 – 207, 419 – 438, 494 – 500.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3627; Нарушение авторских прав?; Мы поможем в написании вашей работы!